Etil-p-metossicinnamato: La Molecola Naturale che Affama il Cancro Bloccando i Grassi (e Non Solo lo Zucchero!)
Ragazzi, parliamoci chiaro: il cancro è una brutta bestia. Una delle sue caratteristiche più note è la capacità di riprogrammare il proprio metabolismo energetico per crescere a dismisura. Per anni abbiamo sentito parlare dell’effetto Warburg: in pratica, le cellule tumorali sembrano preferire la glicolisi (il modo “veloce” ma meno efficiente di produrre energia dallo zucchero) anche quando c’è ossigeno, un po’ come un atleta che fa uno sprint continuo invece di una maratona. Si pensava che i loro “motori” principali, i mitocondri, fossero danneggiati.
Ma se vi dicessi che a volte la storia è più complicata? Ricerche recenti, inclusa quella di cui vi parlo oggi, stanno mettendo in discussione questa visione un po’ troppo semplicistica. Sembra che, almeno in alcuni casi, non sia la glicolisi la vera star dello show energetico del cancro, ma qualcos’altro. E qui entra in gioco una molecola naturale davvero interessante.
Alla Scoperta dell’EMC: Un Aiuto dalla Natura
Nel vasto mondo dei composti naturali, che da sempre ci offrono rimedi e ispirazione, ho messo gli occhi su una molecola chiamata Etil-p-metossicinnamato, o più semplicemente EMC. Si trova in una pianta medicinale affascinante, la Kaempferia galanga L., della stessa famiglia dello zenzero. Già in studi precedenti avevamo visto che l’estratto di questa pianta e l’EMC stesso riuscivano a frenare la crescita di cellule tumorali specifiche, le cellule del tumore ascitico di Ehrlich (EATC), bloccandole in una fase precisa del loro ciclo di divisione (la transizione G1/S) e mettendo i bastoni tra le ruote a un “cattivo” noto nel mondo del cancro, l’oncogene c-Myc.
Ma la domanda rimaneva: come faceva l’EMC a influenzare l’energia di queste cellule? Era arrivato il momento di scavare più a fondo nel metabolismo.
Il Colpo di Scena: Glicolisi Potenziata, Ma Energia KO!
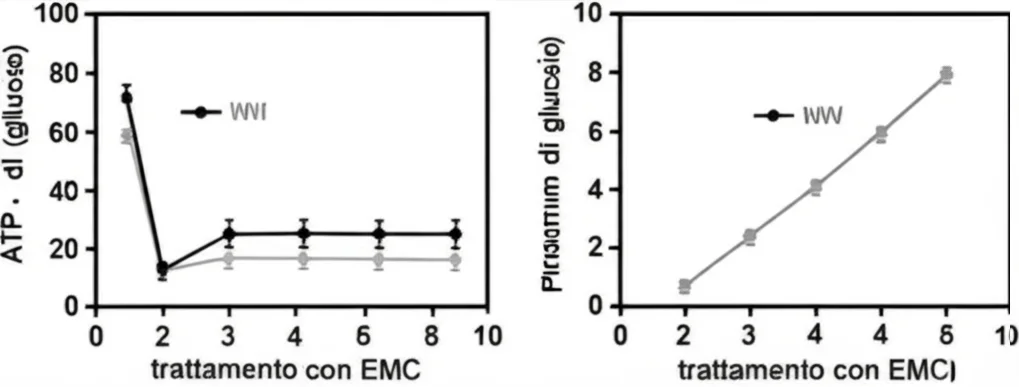
L’ipotesi più ovvia, basandoci sull’effetto Warburg, era che l’EMC bloccasse la glicolisi, tagliando così i viveri energetici (l’ATP, la nostra “moneta” energetica cellulare) alle cellule tumorali. E invece? Sorpresa! Abbiamo trattato le cellule EATC con EMC e abbiamo misurato cosa succedeva. Risultato: le cellule consumavano più glucosio e producevano più lattato, segni inequivocabili di una glicolisi potenziata, non inibita!
Eppure, nonostante questa “accelerata” sulla via dello zucchero, i livelli di ATP intracellulare diminuivano drasticamente. Un bel rompicapo, vero? Se non era la glicolisi a essere bloccata, cosa stava succedendo? Dove stava la falla energetica?
Il Vero Bersaglio: La Fabbrica dei Grassi
Allora, dove sta il trucco? Indovinate un po’? Nei grassi! Le cellule tumorali non hanno bisogno solo di zuccheri, ma anche di mattoni per costruire le loro membrane e, come stiamo scoprendo, anche di grassi come fonte energetica alternativa o complementare. In particolare, sono ghiotte di un processo chiamato sintesi degli acidi grassi de novo (DNFS), cioè la capacità di costruirsi i grassi da sole, partendo da molecole più semplici come il citrato. Le cellule normali, di solito, preferiscono usare i grassi che assumiamo con la dieta.
Abbiamo quindi controllato cosa faceva l’EMC a questa “fabbrica interna” di grassi. Bingo! L’EMC andava a spegnere gli interruttori principali di questa fabbrica. Abbiamo visto che riduceva significativamente l’espressione dei geni chiave per la DNFS:
- Acly (ATP citrato liasi)
- Acc1 (Acetil-CoA carbossilasi alfa)
- Fasn (Acido grasso sintasi)
Questi enzimi sono fondamentali per convertire il citrato in acido palmitico (PA), un mattone base per molti grassi. E infatti, come conseguenza, abbiamo misurato una netta diminuzione dei trigliceridi (TG), la forma di “stoccaggio” dei grassi, all’interno delle cellule trattate con EMC. È importante notare che l’EMC non sembrava invece influenzare l’ossidazione dei grassi, cioè il processo inverso di “bruciare” i grassi per produrre energia.
La Prova del Nove: L’Acido Palmitico Salva la Situazione
Per essere sicuri che fosse proprio il blocco della sintesi dei grassi a causare il calo di ATP, abbiamo fatto un esperimento cruciale. Abbiamo trattato le cellule con EMC (che blocca la produzione interna di grassi) e contemporaneamente abbiamo fornito loro dall’esterno dell’acido palmitico (PA), il prodotto finale che non riuscivano più a sintetizzare.
Il risultato? Spettacolare! L’aggiunta di acido palmitico riusciva a invertire completamente il calo di ATP indotto dall’EMC. Non solo: l’acido palmitico riusciva anche a contrastare l’effetto anti-proliferativo dell’EMC, permettendo alle cellule di ricominciare a moltiplicarsi quasi normalmente. Questo ci ha dato la conferma definitiva: è proprio bloccando la sintesi dei grassi de novo che l’EMC toglie energia alle cellule tumorali EATC e ne frena la crescita. Curiosamente, l’EMC non uccideva le cellule (non induceva apoptosi), ma le “addormentava” bloccandone la proliferazione.

Mettere Insieme i Pezzi: Energia, Ciclo Cellulare e Interruttori Molecolari
Ma come fa l’EMC a orchestrare tutto questo? Abbiamo collegato i puntini. Sappiamo che la mancanza di energia (basso ATP) viene “sentita” dalla cellula a livello dei checkpoint del ciclo cellulare, meccanismi di controllo che possono bloccare la divisione se qualcosa non va. E infatti, abbiamo visto che il calo di ATP indotto dall’EMC avveniva proprio in concomitanza con l’arresto delle cellule nella fase di transizione G1/S, quella che precede la duplicazione del DNA. Senza energia sufficiente, la cellula non può permettersi di duplicarsi.
Ma chi tira le fila a monte? Qui ritornano in gioco i nostri “vecchi amici”: l’oncogene c-Myc e un altro fattore chiave chiamato SREBP1 (Sterol Regulatory Element-Binding Protein 1). SREBP1 è un “capo” che regola direttamente i geni della sintesi dei grassi (Acly, Acc1, Fasn). E chi regola SREBP1? Proprio c-Myc!
Abbiamo scoperto che l’EMC agisce su questa catena di comando. Non riduce la quantità totale di c-Myc, ma ne impedisce una modifica cruciale (la fosforilazione sul residuo Serina 62) che serve ad attivarlo. Un c-Myc meno attivo significa meno stimolo per SREBP1. E infatti, abbiamo visto che l’EMC riduceva sia l’mRNA che i livelli della proteina SREBP1 (sia nella sua forma precursore che in quella matura e attiva). Meno SREBP1 attivo porta a una minore espressione dei geni della sintesi dei grassi, ed ecco che il cerchio si chiude: meno grassi sintetizzati, meno ATP, arresto della crescita.
Perché Tutto Questo è Importante?
Capite la portata di questa scoperta? Ci dice che, almeno per queste cellule tumorali (e potenzialmente per altre), la sintesi dei grassi de novo è fondamentale per mantenere l’equilibrio energetico, forse anche più della tanto citata glicolisi. L’EMC ci ha mostrato una vulnerabilità inaspettata.
Questo apre scenari terapeutici nuovi ed eccitanti. Potremmo pensare di colpire il cancro proprio sulla sua capacità di produrre grassi. Anzi, visto che l’EMC potenzia la glicolisi (forse come meccanismo disperato di compensazione della cellula), una strategia ancora più potente potrebbe essere quella di combinare un inibitore della sintesi dei grassi come l’EMC con un inibitore della glicolisi. Un doppio colpo per affamare veramente le cellule tumorali!

Cosa Ci Riserva il Futuro?
Certo, la ricerca non finisce qui. Questo studio si è concentrato sulle cellule EATC e su specifici percorsi metabolici. Sarà fondamentale capire se l’EMC ha effetti simili su altri tipi di cancro e indagare il suo impatto su altre vie metaboliche importanti (come il metabolismo della glutammina o il ciclo di Krebs). Inoltre, sarà utile confrontare l’azione dell’EMC con altri inibitori noti della sintesi dei grassi.
Ma il messaggio chiave è forte e chiaro: l’Etil-p-metossicinnamato è una molecola promettente che ci insegna molto sulla complessità del metabolismo tumorale. Ci ricorda che per combattere il cancro dobbiamo guardare oltre le vie più battute e che la natura può ancora offrirci armi inaspettate ed efficaci. La capacità di bloccare la produzione di grassi, affamando le cellule tumorali e bloccandone la crescita, è una strategia che merita sicuramente di essere esplorata a fondo. Chissà quali altre sorprese ci riserva questa piccola molecola derivata da una pianta!
Fonte: Springer