Tumore Renale: Come le Cellule Maligne “Corrompono” i Fibroblasti per Espandersi
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante all’interno del corpo umano, precisamente nel complesso mondo dei tumori, e in particolare del carcinoma renale a cellule chiare (ccRCC). Spesso pensiamo al tumore come a un’entità isolata, un gruppo di cellule impazzite che crescono senza controllo. Ma la realtà è molto più intricata. Un tumore è un ecosistema complesso, un “microambiente” brulicante di interazioni, e capire queste interazioni è fondamentale per combatterlo.
Recentemente, la ricerca ha fatto passi da gigante nello svelare i meccanismi nascosti dietro la progressione tumorale, e una scoperta particolarmente intrigante riguarda delle minuscole vescicole chiamate esosomi. Immaginatele come dei “postini” cellulari che trasportano messaggi cruciali da una cellula all’altra. Ebbene, sembra proprio che le cellule del tumore renale utilizzino questi postini per “corrompere” le cellule vicine, in particolare i fibroblasti, trasformandoli in alleati involontari della malattia. Pronti a scoprire come avviene questo subdolo inganno?
Il Microambiente Tumorale: Un Campo di Battaglia Complesso
Prima di tuffarci negli esosomi, facciamo un passo indietro. Il microambiente tumorale (TME) è tutto ciò che circonda le cellule cancerose: vasi sanguigni, cellule immunitarie, matrice extracellulare e, appunto, i fibroblasti. I fibroblasti sono cellule normalmente innocue, anzi utili, presenti nel tessuto connettivo, responsabili della produzione della matrice che dà struttura ai nostri organi.
Tuttavia, in presenza di un tumore, qualcosa cambia. I fibroblasti possono venire “attivati” e trasformarsi in quelli che chiamiamo fibroblasti associati al cancro (CAFs). Questi CAFs non sono più semplici spettatori, ma diventano protagonisti attivi nel dramma tumorale. Studi recenti, inclusi quelli basati su analisi di singole cellule (single-cell sequencing), hanno mostrato che nei tumori renali in stadio avanzato, quelli con metastasi o trombi tumorali nella vena cava, la proporzione di CAFs è significativamente più alta rispetto ai tumori localizzati. È come se il tumore, diventando più aggressivo, reclutasse sempre più “soldati” tra i fibroblasti. Questi CAFs, una volta attivati, iniziano a produrre fattori pro-infiammatori e a modificare l’ambiente circostante, rendendolo più favorevole alla crescita e alla diffusione del tumore. Ma come avviene questa trasformazione? Qui entrano in gioco i nostri piccoli messaggeri.
Gli Esosomi: Messaggeri Segreti del Tumore
Scoperti negli anni ’80, gli esosomi sono vescicole piccolissime (50-150 nanometri di diametro) rilasciate da quasi tutte le cellule del nostro corpo. Sono come delle capsule che contengono un carico prezioso: proteine, lipidi, e soprattutto materiale genetico come RNA e microRNA (miRNA). Viaggiando nei fluidi corporei, possono essere assorbiti da altre cellule, consegnando il loro carico e influenzandone il comportamento.
Nel contesto tumorale, gli esosomi sono diventati un’area di ricerca caldissima. Si è capito che le cellule cancerose li usano come strumento di comunicazione a distanza per manipolare il microambiente a proprio vantaggio. Possono promuovere la formazione di nuovi vasi sanguigni (angiogenesi), sopprimere la risposta immunitaria e, come stiamo per vedere, riprogrammare le cellule stromali come i fibroblasti. Nel caso del ccRCC, la domanda cruciale era: cosa c’è dentro gli esosomi rilasciati dalle cellule tumorali che riesce a trasformare un normale fibroblasto (NF) in un CAF pro-tumorale?
La Scoperta Chiave: Come il Tumore Renale “Corrompe” i Fibroblasti
Studiando i CAFs isolati da tumori renali a diversi stadi di progressione, i ricercatori hanno notato differenze significative rispetto ai fibroblasti normali (NFs). I CAFs provenienti da tumori avanzati non solo erano più abbondanti, ma mostravano anche caratteristiche diverse, tra cui una maggiore capacità di promuovere la migrazione e l’invasività delle cellule tumorali, anche attraverso gli esosomi che essi stessi rilasciavano! Ma il vero colpo di scena è arrivato analizzando gli esosomi prodotti *dalle cellule tumorali* e il loro effetto sui fibroblasti *normali*.
Si è scoperto che gli esosomi derivati dalle cellule di ccRCC, specialmente quelle più metastatiche, contengono alti livelli di un particolare microRNA: il miR-222-3p. Quando questi esosomi vengono assorbiti dai fibroblasti normali, il miR-222-3p entra in azione e fa qualcosa di specifico: silenzia un gene chiamato PANK3.
PANK3: Un Guardiano Soppresso
PANK3 (Pantotenato Chinasi 3) è un enzima chiave nel metabolismo cellulare, coinvolto nella sintesi del Coenzima A, una molecola fondamentale per una miriade di processi energetici. Analizzando i dati di pazienti affetti da ccRCC (dal database TCGA-KIRC), si è osservato che:
- L’espressione di PANK3 è significativamente più bassa nei tessuti tumorali rispetto a quelli normali adiacenti.
- Livelli più bassi di PANK3 sono associati a stadi tumorali più avanzati (T stage).
- Pazienti con livelli più alti di PANK3 hanno una prognosi migliore e una sopravvivenza più lunga.
- L’espressione di PANK3 è risultata essere un fattore prognostico indipendente.
In pratica, PANK3 sembra agire come un “guardiano” del normale metabolismo e della stabilità cellulare. La sua soppressione da parte del miR-222-3p contenuto negli esosomi tumorali è un passo cruciale nell’attivazione dei fibroblasti. Quando PANK3 viene artificialmente ridotto nei fibroblasti normali (usando tecniche come siPANK3), queste cellule iniziano a comportarsi come CAFs: aumentano l’espressione dei marcatori tipici dei CAFs (come α-SMA e FAP), producono più fattori infiammatori e, cosa fondamentale, cambiano radicalmente il loro metabolismo.
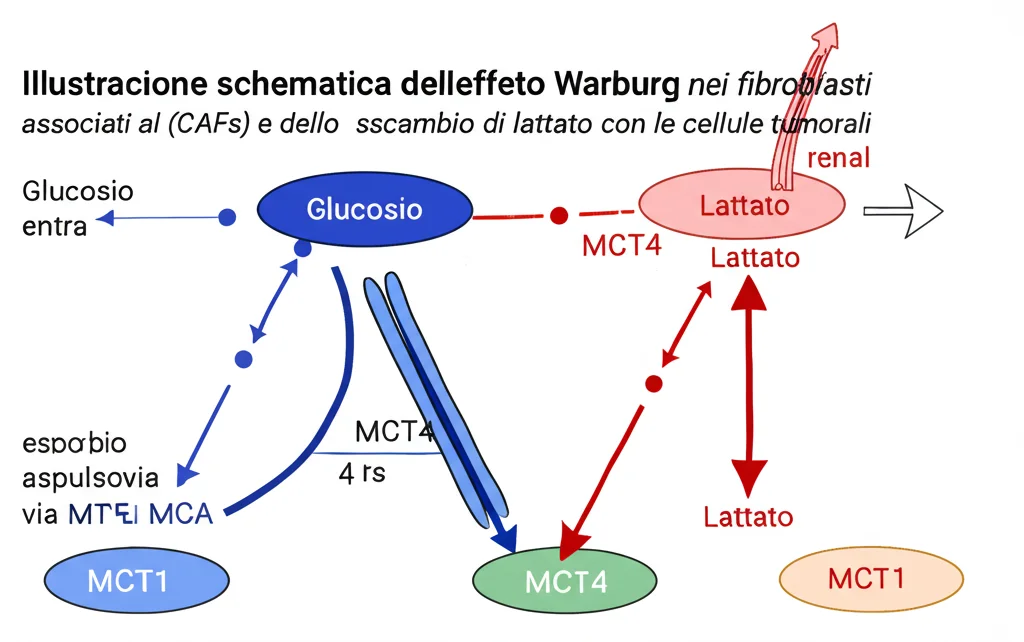
L’Effetto Warburg e lo “Scambio” di Energia
Qui le cose si fanno ancora più interessanti. La riduzione di PANK3 nei fibroblasti li spinge ad adottare un metabolismo alterato noto come effetto Warburg o glicolisi aerobica. In condizioni normali, le cellule producono energia principalmente attraverso la respirazione mitocondriale, un processo molto efficiente che richiede ossigeno. Le cellule tumorali, e a quanto pare anche i CAFs da loro “istruiti”, preferiscono invece la glicolisi, un processo meno efficiente che avviene anche in presenza di ossigeno e che produce come scarto grandi quantità di acido lattico.
Perché fare questo? Sembra controintuitivo, ma questa via metabolica fornisce rapidamente “mattoni” per la crescita cellulare e crea un ambiente acido che favorisce l’invasione. Ma c’è di più: i CAFs, dopo aver prodotto acido lattico in abbondanza, lo espellono attivamente all’esterno tramite un trasportatore chiamato MCT4. E chi è pronto ad approfittarne? Le cellule tumorali! Queste ultime esprimono un altro trasportatore, MCT1, che permette loro di assorbire l’acido lattico rilasciato dai CAFs e di utilizzarlo come “carburante” supplementare per la loro crescita e malignità. Si crea così una sorta di “navetta del lattato” (lactic acid shuttle), una simbiosi metabolica perversa in cui i fibroblasti attivati nutrono letteralmente il tumore che li ha corrotti. Esperimenti in vivo hanno confermato che bloccando MCT1 nelle cellule tumorali si riesce a inibire la crescita del tumore stesso.
miR-222-3p: Il “Messaggio” nell’Esosoma
Torniamo al nostro messaggero iniziale, il miR-222-3p. La sua importanza è stata confermata da diverse angolazioni:
- È sovraespresso nei CAFs rispetto ai NFs.
- È più abbondante nei tessuti di ccRCC rispetto ai tessuti normali, e i suoi livelli aumentano con lo stadio del tumore.
- Alti livelli di miR-222-3p nei tessuti tumorali o negli esosomi circolanti sono associati a una prognosi peggiore e a una maggiore probabilità di metastasi.
- È presente in quantità maggiori negli esosomi rilasciati da linee cellulari di ccRCC più metastatiche.
- Esperimenti di laboratorio (come il saggio della luciferasi) hanno confermato che miR-222-3p si lega direttamente alla sequenza del gene PANK3, inibendone l’espressione.
- Trattare fibroblasti normali con un “mimico” di miR-222-3p induce cambiamenti simili a quelli visti nei CAFs (aumento ROS, fattori infiammatori).
- Al contrario, inibire miR-222-3p nei fibroblasti dove PANK3 era stato silenziato artificialmente riesce a contrastare l’attivazione a CAF.
Quindi, il quadro è chiaro: le cellule del tumore renale, soprattutto quelle aggressive, impacchettano miR-222-3p negli esosomi; questi vengono captati dai fibroblasti; miR-222-3p silenzia PANK3; la mancanza di PANK3 scatena l’attivazione a CAF e l’effetto Warburg; i CAFs rilasciano lattato che alimenta il tumore. Un circolo vizioso perfettamente orchestrato.
Implicazioni e Speranze Future
Capire questo complesso dialogo tra cellule tumorali e fibroblasti, mediato dagli esosomi e incentrato sull’asse miR-222-3p/PANK3/metabolismo del lattato, apre scenari terapeutici davvero promettenti. Se riuscissimo a interrompere questa comunicazione, potremmo forse frenare la progressione del tumore renale avanzato.
Le possibili strategie potrebbero includere:
- Bloccare il rilascio o l’assorbimento degli esosomi contenenti miR-222-3p.
- Inattivare il miR-222-3p all’interno dei fibroblasti usando specifici inibitori (antimiR).
- Ripristinare l’attività di PANK3 nei fibroblasti.
- Inibire i trasportatori del lattato MCT1 (sulle cellule tumorali) o MCT4 (sui CAFs) per interrompere la navetta metabolica.
- Utilizzare i livelli di miR-222-3p (nel tumore o negli esosomi circolanti) come biomarcatore per predire la prognosi e guidare le scelte terapeutiche.
Certo, la strada è ancora lunga e serviranno ulteriori ricerche per tradurre queste scoperte in terapie efficaci e sicure per i pazienti. Tuttavia, ogni passo avanti nella comprensione di questi meccanismi molecolari ci avvicina all’obiettivo di sconfiggere malattie complesse come il carcinoma renale a cellule chiare.
È affascinante vedere come le cellule tumorali abbiano evoluto strategie così sofisticate per manipolare l’ambiente circostante. Studiare queste strategie è come decifrare un codice segreto, un codice che speriamo un giorno di poter usare contro il tumore stesso. Continuiamo a seguire la ricerca, perché le prossime scoperte potrebbero essere proprio dietro l’angolo!
Fonte: Springer