Cancro al Pancreas: Abbiamo Svelato un Interruttore Molecolare che Accelera la Malattia!
Ciao a tutti! Oggi voglio parlarvi di un argomento tosto, il cancro al pancreas. Sapete, è una di quelle malattie che purtroppo si porta via troppe persone, classificandosi come la quarta causa principale di morte per cancro. E le previsioni non sono rosee: si stima che entro il 2040 possa diventare addirittura la seconda. Uno dei motivi principali di questa aggressività è la sua tendenza a invadere i tessuti circostanti e a formare metastasi in altri organi molto rapidamente.
Al centro di questo comportamento aggressivo c’è un processo affascinante, dal punto di vista biologico ovviamente, chiamato transizione epitelio-mesenchimale (EMT). Immaginate le cellule tumorali come soldati che cambiano uniforme: abbandonano le loro caratteristiche “civili” (epiteliali) per indossare una divisa da “assalto” (mesenchimale), diventando più mobili, invasive e resistenti alle terapie, inclusa l’immunoterapia.
Il Protagonista Oscuro: ZEB1
In questa trasformazione gioca un ruolo da protagonista un fattore di trascrizione chiamato ZEB1 (Zinc Finger E-Box Binding Homeobox 1). Pensatelo come un direttore d’orchestra che coordina l’EMT, promuovendo non solo la mobilità e la diffusione delle cellule tumorali, ma anche la loro capacità di resistere ai trattamenti e di sfuggire al sistema immunitario. La sua attività è finemente regolata, e una delle modifiche chiave che ne influenzano il comportamento è la fosforilazione, ovvero l’aggiunta di un gruppo fosfato in punti specifici della proteina. Questa modifica può accendere o spegnere ZEB1, spostarlo all’interno della cellula o cambiarne la stabilità. Tuttavia, capire esattamente cosa succede quando ZEB1 viene fosforilato in un sito specifico e quali sono le conseguenze *in vivo* è ancora un puzzle complesso.
La Scintilla della Scoperta: SPC e la Doppia Faccia di ZEB1
Nel nostro studio, ci siamo imbattuti in un indizio interessante. Abbiamo osservato che alcune molecole note per indurre l’EMT, come il TGF-β1 e una molecola chiamata sfingosilfosforilcolina (SPC), sembravano attivare ZEB1 in un modo particolare. L’SPC, in particolare, è interessante perché si trova a livelli elevati nel plasma di pazienti con sindrome metabolica, una condizione associata a un aumentato rischio di cancro al pancreas. Inoltre, l’SPC è prodotto dalle piastrine, e un alto rapporto piastrine/linfociti è considerato un fattore prognostico negativo nel cancro al pancreas.
Abbiamo quindi testato l’effetto dell’SPC su linee cellulari di cancro al pancreas (PANC-1 e HPAC). Ebbene, abbiamo visto che l’SPC induceva l’EMT in queste cellule: perdevano l’adesione tipica delle cellule epiteliali (calo di E-caderina) e acquisivano caratteristiche mesenchimali (aumento di N-caderina, vimentina, Snail e dello stesso ZEB1). Le cellule diventavano anche più mobili e invasive. Ma la cosa più intrigante era che, analizzando ZEB1 con tecniche specifiche (immunoblotting), vedevamo spesso due bande invece di una. Questo “doppietto” suggeriva, come riportato in letteratura, la presenza di forme di ZEB1 diversamente fosforilate: una “ipo-fosforilata” (banda inferiore) e una “iper-fosforilata” (banda superiore). L’SPC sembrava proprio aumentare la forma iper-fosforilata! Non solo, abbiamo notato che l’SPC spingeva ZEB1 a spostarsi dal citoplasma al nucleo della cellula, dove può agire come fattore di trascrizione.
ZEB1 e lo Scudo Immunitario: il Legame con PD-L1
L’EMT non è solo una questione di movimento cellulare. Negli ultimi anni è emerso un legame preoccupante tra EMT e resistenza immunitaria. Le cellule tumorali che subiscono EMT spesso aumentano l’espressione di molecole che “spengono” le cellule del sistema immunitario, come la famosa PD-L1 (Programmed Death-Ligand 1). Ci siamo chiesti: ZEB1, il nostro direttore d’orchestra dell’EMT, influenza anche PD-L1? La risposta è stata un sonoro sì! Silenziando ZEB1 nelle cellule tumorali, abbiamo visto diminuire l’espressione di PD-L1. Al contrario, sovraesprimendo ZEB1, i livelli di PD-L1 aumentavano significativamente. Questo ci ha fatto capire che la fosforilazione di ZEB1 indotta da SPC o TGF-β1 non solo promuove l’EMT, ma potrebbe anche aiutare il tumore a nascondersi dal sistema immunitario.
Alla Ricerca del Colpevole: Chi Fosforila ZEB1?
A questo punto, la domanda era: quale “interruttore” molecolare, quale chinasi, è responsabile della fosforilazione di ZEB1 indotta da SPC? La letteratura suggeriva che l’SPC attivasse principalmente le vie di segnalazione delle chinasi MAPK, in particolare ERK1/2 e JNK. Ci siamo concentrati su ERK1/2, anche perché alcuni studi indicavano un ruolo specifico di ERK2 (e non ERK1) nell’EMT.
Utilizzando inibitori specifici, abbiamo scoperto che bloccando la via MEK/ERK1/2 (con l’inibitore U0126), riuscivamo a sopprimere i cambiamenti morfologici indotti da SPC, la perdita di E-caderina, l’espressione e la fosforilazione di ZEB1, e persino la sua traslocazione nel nucleo. Anche la migrazione e l’invasione cellulare indotte da SPC venivano ridotte. Era chiaro: la via MEK/ERK era coinvolta.
Ma era ERK1 o ERK2 il vero responsabile? Con esperimenti di co-immunoprecipitazione (una tecnica per vedere quali proteine interagiscono tra loro), abbiamo fatto una scoperta chiave: ZEB1 si legava preferenzialmente a ERK2, soprattutto quando quest’ultimo era attivato (fosforilato, pERK2). Il legame con ERK1 era molto meno evidente. Sembrava proprio che ZEB1 avesse un partner preferenziale!
Il Bersaglio Preciso: Serina 322
Ok, ERK2 si lega a ZEB1. Ma lo fosforila? E dove esattamente? Le chinasi come ERK2 riconoscono sequenze specifiche sulle proteine bersaglio. Analizzando la sequenza di ZEB1, abbiamo identificato due potenziali siti di fosforilazione da parte di ERK, la serina 322 (S322) e la serina 646 (S646). La S322 era particolarmente interessante perché risultava frequentemente fosforilata in studi precedenti su larga scala.
Per confermare, abbiamo condotto esperimenti *in vitro*: abbiamo purificato ZEB1 e ERK2 e li abbiamo messi insieme in provetta con ATP radioattivo (per “vedere” la fosforilazione). Risultato: ERK2 “normale” (wild-type) fosforilava ZEB1. Ma quando abbiamo usato una versione mutata di ZEB1 in cui la serina 322 era sostituita da un’alanina (S322A), la fosforilazione da parte di ERK2 era drasticamente ridotta! Abbiamo testato anche la mutazione S646A, e sebbene ci fosse una riduzione, era meno marcata rispetto a S322A. Quindi, S322 era il sito principale di fosforilazione da parte di ERK2.
Abbiamo anche dato un’occhiata ai dati di espressione genica da database pubblici (GTEx per tessuti normali, TCGA per tumori). Nel pancreas normale, l’espressione di ZEB1 è più correlata a ERK1. Ma nel cancro al pancreas (adenocarcinoma), la correlazione più forte è con ERK2! Un’ulteriore conferma che l’asse ERK2-ZEB1 è particolarmente rilevante in questo tumore.

Le Conseguenze della Fosforilazione su S322
Ora sapevamo che ERK2 fosforila ZEB1 su S322. Ma cosa comporta questa specifica fosforilazione? Per capirlo, abbiamo creato delle linee cellulari “ingegnerizzate”. Prima abbiamo silenziato ZEB1 endogeno (shZEB1), poi abbiamo reintrodotto diverse versioni di ZEB1:
- ZEB1 normale (pZEB1)
- ZEB1 mutato in S322A (pS322A), che non può essere fosforilato in quel sito.
- ZEB1 mutato in S322D (pS322D), che “mimica” la fosforilazione costante su S322.
I risultati sono stati illuminanti:
- Morfologia ed EMT: Le cellule con ZEB1 normale (pZEB1) o con la forma “sempre fosforilata” (pS322D) mostravano una morfologia mesenchimale, con bassa E-caderina e alta N-caderina/vimentina. Al contrario, le cellule con ZEB1 non fosforilabile (pS322A) mantenevano un aspetto epiteliale, simile alle cellule di controllo senza ZEB1.
- Localizzazione: ZEB1 normale e ZEB1 S322D si trovavano prevalentemente nel nucleo. ZEB1 S322A, invece, faticava a entrare nel nucleo e rimaneva più nel citoplasma. La fosforilazione su S322 sembra quindi cruciale per la sua traslocazione nucleare!
- Migrazione e Invasione: Come previsto, le cellule con pZEB1 e pS322D erano molto più mobili e invasive rispetto ai controlli e alle cellule con pS322A.
- Espressione di PD-L1: Qui la conferma che cercavamo! Le cellule con pZEB1 e pS322D mostravano livelli significativamente più alti di PD-L1 rispetto alle cellule con pS322A.
In sintesi: la fosforilazione di ZEB1 su S322 da parte di ERK2 è un evento chiave che ne promuove l’ingresso nel nucleo, scatena l’EMT, aumenta la capacità invasiva e, cosa importantissima, potenzia l’espressione di PD-L1, aiutando il tumore a eludere il sistema immunitario.
La Prova del Nove: il Modello Animale
Le scoperte in provetta sono fondamentali, ma la vera prova è vedere cosa succede in un organismo vivente. Abbiamo quindi utilizzato un modello murino ortotopico: abbiamo iniettato le nostre diverse linee cellulari direttamente nel pancreas di topi immunodeficienti e abbiamo monitorato la crescita tumorale e la formazione di metastasi.
I risultati hanno confermato pienamente i dati *in vitro*:
- I topi iniettati con cellule esprimenti ZEB1 normale (pZEB1) o la forma S322D (sempre fosforilata) sviluppavano tumori più grandi e mostravano una maggiore incidenza di metastasi (soprattutto al fegato e ai linfonodi mesenterici) rispetto ai topi di controllo o a quelli iniettati con cellule esprimenti ZEB1 S322A (non fosforilabile).
- L’analisi istologica dei tumori confermava i cambiamenti nei marcatori EMT (bassa E-caderina, alta N-caderina) e livelli più alti di ZEB1 e PD-L1 nei gruppi pZEB1 e pS322D rispetto al gruppo pS322A.
Questi esperimenti *in vivo* dimostrano in modo convincente che la fosforilazione di ZEB1 su S322 è un motore potente per la progressione e la metastatizzazione del cancro al pancreas. Bloccare questa fosforilazione sembra poter frenare la malattia.
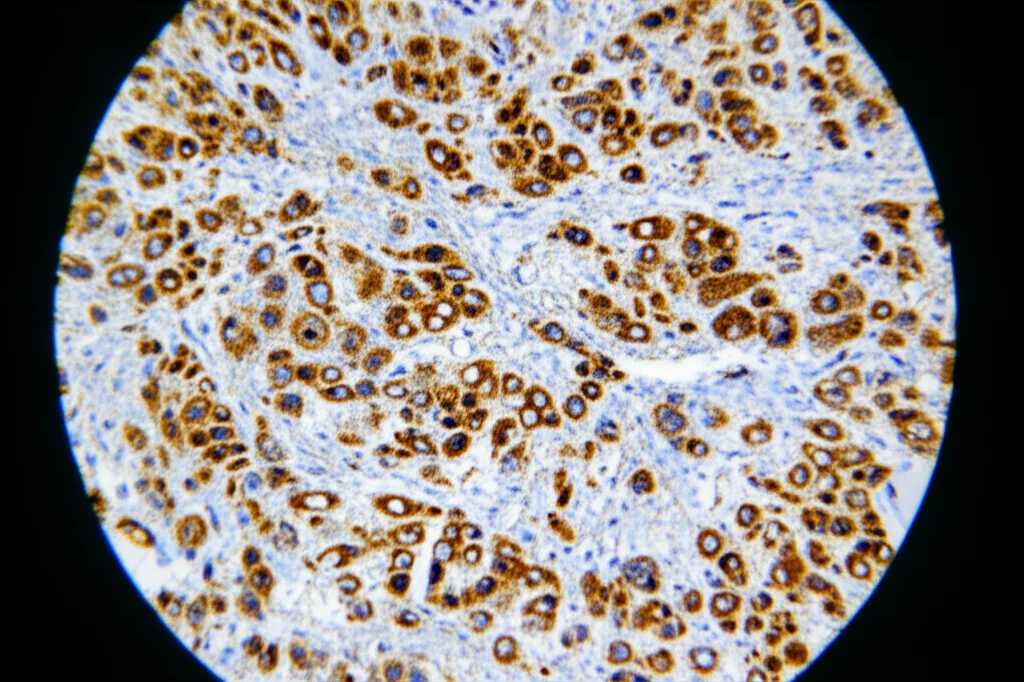
Uno Strumento per il Futuro: l’Anticorpo Anti-pS322 ZEB1
Avere scoperto questo meccanismo è importante, ma sarebbe ancora più utile poter “vedere” direttamente ZEB1 fosforilato su S322 nei campioni tumorali. Per questo, abbiamo sviluppato e validato un anticorpo specifico (che abbiamo chiamato abpZEB1S322) in grado di riconoscere ZEB1 solo quando è fosforilato su S322.
Abbiamo testato questo anticorpo e confermato che:
- Riconosce ZEB1 fosforilato indotto da SPC e questo riconoscimento viene bloccato dall’inibitore di MEK/ERK (U0126).
- Rileva ZEB1 fosforilato prevalentemente nella frazione nucleare delle cellule.
- Funziona bene in diverse tecniche, inclusa l’immunoistochimica su tessuti.
La cosa più entusiasmante è che, utilizzando questo anticorpo su array di tessuti umani, abbiamo osservato una colorazione significativamente più intensa per pS322 ZEB1 nei tessuti di cancro al pancreas rispetto ai tessuti pancreatici normali. Questo suggerisce che il nostro anticorpo potrebbe diventare uno strumento prezioso per la diagnosi o, ancora meglio, per la prognosi del cancro al pancreas. Analizzando dati pubblici di sopravvivenza, abbiamo notato che alti livelli combinati di ZEB1 ed ERK2 (e ancora di più se si aggiunge KRAS, spesso mutato in questo tumore) sono associati a una prognosi peggiore. Un anticorpo che rileva direttamente la forma attiva fosforilata di ZEB1 potrebbe essere ancora più predittivo.
Conclusioni e Prospettive
Quindi, cosa abbiamo imparato? Abbiamo svelato un meccanismo molecolare cruciale nel cancro al pancreas: la chinasi ERK2 (e non ERK1) fosforila il fattore di trascrizione ZEB1 sul sito specifico Serina 322. Questa fosforilazione agisce come un interruttore che:
- Spinge ZEB1 nel nucleo.
- Attiva la transizione epitelio-mesenchimale (EMT), rendendo le cellule più invasive.
- Aumenta l’espressione di PD-L1, aiutando il tumore a sfuggire al sistema immunitario.
- Promuove la crescita tumorale e la formazione di metastasi *in vivo*.
Questa scoperta apre nuove prospettive. L’asse ERK2/pS322-ZEB1 emerge come un potenziale bersaglio terapeutico. Inibire ERK2 o specificamente la fosforilazione di ZEB1 su S322 potrebbe essere una strategia per contrastare la progressione del cancro al pancreas. Inoltre, il nostro anticorpo anti-pS322 ZEB1 potrebbe diventare un utile biomarcatore per valutare la prognosi dei pazienti e forse guidare le scelte terapeutiche, magari in combinazione con immunoterapie o terapie mirate alla via di Ras/MAPK, spesso iperattiva in questo tumore.
È stata una ricerca complessa ma affascinante, e speriamo che questi risultati contribuiscano a fare un passo avanti nella lotta contro questa terribile malattia.
Fonte: Springer