Diabete Materno Prima del Concepimento: L’Eredità Nascosta nei Figli (Ce lo Svela il Pesce Zebra!)
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante e un po’ preoccupante allo stesso tempo: come la salute della mamma, *prima ancora di rimanere incinta*, possa lasciare un’impronta profonda sul metabolismo dei suoi futuri figli. Sì, avete capito bene, stiamo parlando di un’eredità che si trasmette ancor prima del concepimento, e lo facciamo grazie a un piccolo aiutante a strisce: il pesce zebra!
Il Problema Crescente del Diabete di Tipo 2
Sapete, il diabete di tipo 2 (T2DM) è un problema di salute globale in continua crescita. La cosa che colpisce è che sta interessando sempre più persone giovani, adolescenti e persino bambini. Spesso si dice che sia colpa dello stile di vita (poca attività fisica, dieta scorretta) e di fattori genetici. In effetti, si nota una chiara aggregazione familiare: se in famiglia c’è il diabete, è più probabile che anche altri membri sviluppino problemi simili, come dislipidemia (grassi sballati nel sangue) e obesità.
Ma c’è un aspetto che stiamo iniziando a capire meglio solo ora: l’impatto del diabete materno sulla prole. La teoria delle “Origini Evolutive della Salute e della Malattia” (DOHAD) ci dice che un ambiente sfavorevole nelle primissime fasi della vita può influenzare il metabolismo per tutta la vita, aumentando il rischio di malattie future. Il diabete pre-gestazionale (PGDM, cioè presente prima della gravidanza) e quello gestazionale sono condizioni comuni in gravidanza, e con l’aumento dell’obesità e dell’età materna, il PGDM è destinato a crescere.
Studi precedenti, ad esempio sui topi, hanno mostrato che l’iperglicemia materna (alti livelli di zucchero nel sangue) prima della gravidanza può causare problemi a lungo termine nella prole, anche se gli ovociti vengono fecondati in vitro e trasferiti in madri sane! Questo suggerisce che qualcosa cambia proprio nell’ovocita, prima ancora che inizi lo sviluppo dell’embrione. Ma studiare questi meccanismi nei mammiferi è complicato, perché la fecondazione è interna e lo sviluppo avviene nell’utero, rendendo difficile separare gli effetti pre-concepimento da quelli durante la gravidanza.
Entra in Scena il Pesce Zebra!
Ed è qui che il nostro amico pesce zebra (Danio rerio) diventa preziosissimo. Perché? Semplice:
- Fecondazione esterna: Le uova vengono fecondate fuori dal corpo della madre. Questo ci permette di isolare gli effetti legati all’ovocita da quelli dell’ambiente uterino iperglicemico.
- Embrioni trasparenti: Possiamo osservare lo sviluppo iniziale in diretta, quasi come guardare un film!
- Metabolismo simile: Sorprendentemente, i pesci zebra condividono con noi e con i topi molti enzimi e vie metaboliche che regolano glucosio e lipidi.
Nel nostro studio, abbiamo voluto capire meglio proprio questo: come l’iperglicemia materna *prima* del concepimento influenzi il metabolismo di zuccheri e grassi (glicolipidico) nei figli.
Creare un Modello di Diabete nel Pesce Zebra
Come abbiamo fatto? Abbiamo preso delle femmine adulte di pesce zebra e le abbiamo immerse in una soluzione di glucosio al 2% per 28 giorni. Un po’ come far fare loro un “bagno zuccherato” prolungato. Abbiamo poi confrontato queste pescioline con un gruppo di controllo tenuto in acqua normale.
I risultati sono stati chiari: le femmine esposte al glucosio hanno mostrato segni tipici del T2DM.
- Aumento di peso e grassi: Il loro indice di massa corporea (BMI), il colesterolo totale (TC) e i trigliceridi (TG) erano significativamente più alti.
- Glicemia e insulina sballate: I livelli di glucosio nel sangue a digiuno (FBG) e di insulina (FINS) erano decisamente elevati già dopo 14 giorni, e lo sono rimasti fino alla fine dell’esperimento (28 giorni).
- Danni agli organi: L’analisi dei tessuti ha rivelato danni al fegato, con accumulo di grasso (steatosi) e infiammazione, e alterazioni nelle ovaie, con un aumento degli ovociti in fase avanzata di vitellogenesi (cioè pieni di tuorlo) e una diminuzione di quelli primari. Questo suggerisce che l’iperglicemia non solo sballa il metabolismo, ma danneggia anche organi chiave per la riproduzione.
Insomma, avevamo creato con successo un modello di T2DM nel pesce zebra femmina.
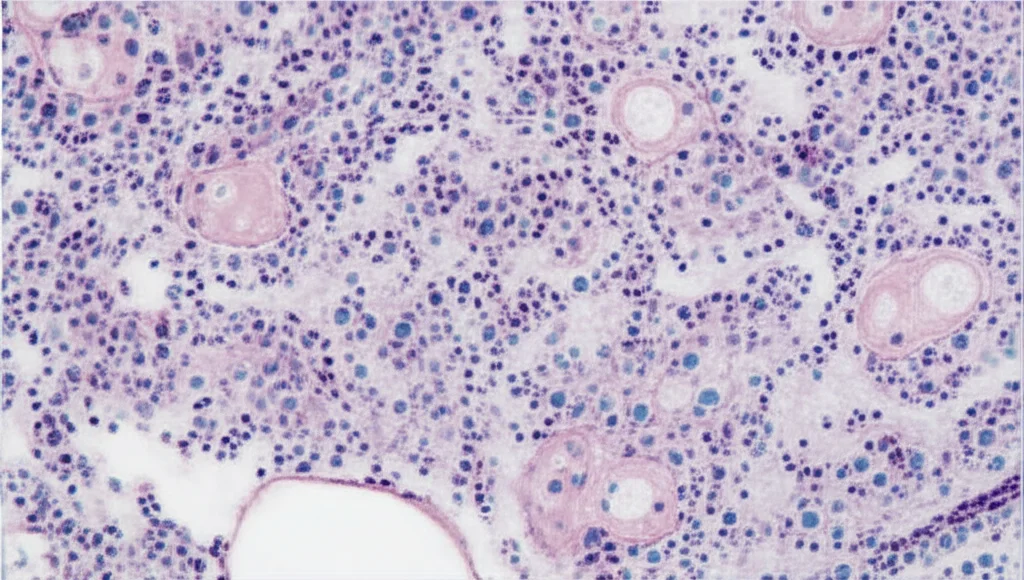
L’Eredità sulla Prole: Sviluppo e Metabolismo Alterati
Ma la vera domanda era: cosa succede ai figli di queste madri “diabetiche”? Abbiamo fatto accoppiare le femmine trattate (a 14, 21 e 28 giorni) con maschi sani (non trattati). Ecco cosa abbiamo osservato nella prole (generazione F1):
Anomalie nello sviluppo:
- Movimenti ridotti: Già a 24 ore dalla fecondazione (hpf), gli embrioni F1 mostravano movimenti spontanei significativamente ridotti, e questo effetto peggiorava con l’aumentare dei giorni di esposizione della madre al glucosio.
- Schiusa accelerata ma…: La schiusa delle uova avveniva prima (a 60 hpf) rispetto al controllo.
- Larve “diverse”: A 72 hpf, le larve F1 avevano un sacco vitellino più grande e una frequenza cardiaca aumentata. A 96 hpf, erano anche più lunghe.
- Flusso sanguigno rallentato: A 60 hpf, la velocità del flusso sanguigno nelle larve F1 era significativamente ridotta.
Questi dati ci dicono che l’iperglicemia materna pre-concepimento interferisce pesantemente con il normale sviluppo dei figli.
Metabolismo Glicolipidico Scombussolato:
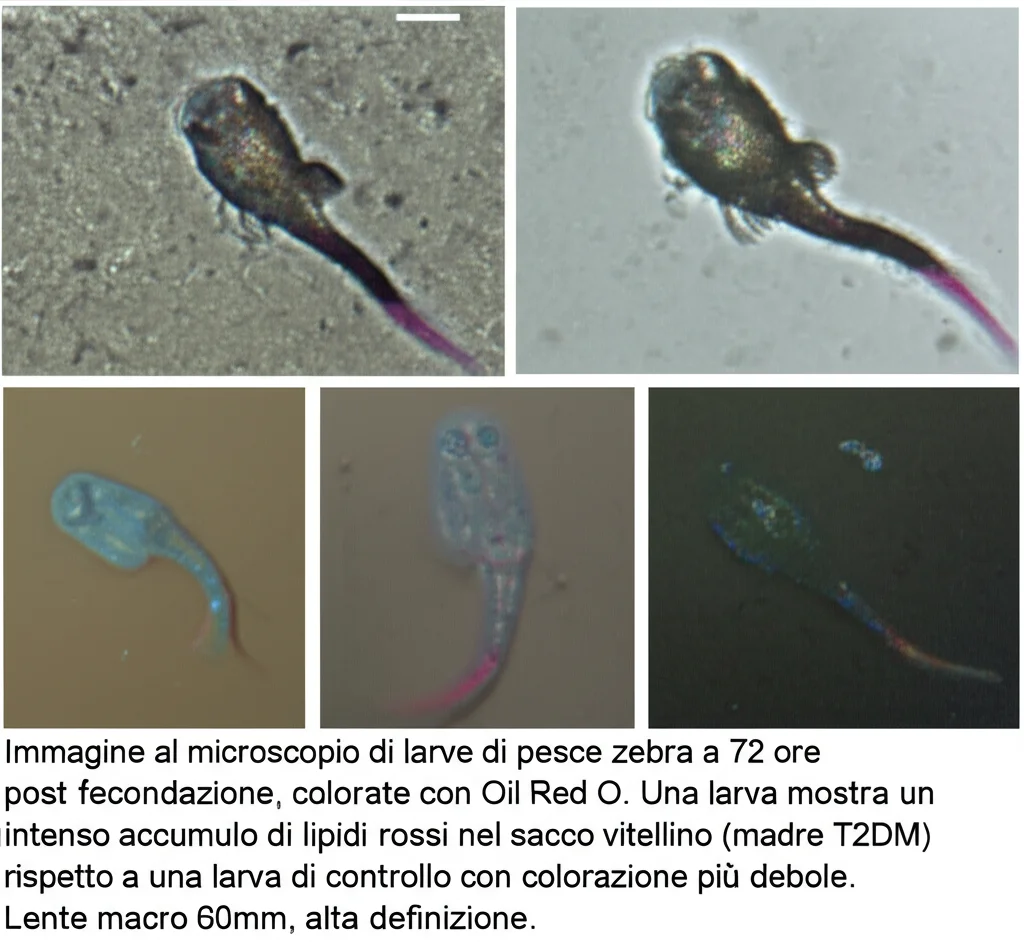
E il metabolismo? Abbiamo usato una colorazione speciale, l’Oil Red O, per visualizzare i grassi nelle larve a 72 hpf.
- Accumulo di grassi: Le larve F1 provenienti da madri T2DM mostravano un accumulo significativamente maggiore di lipidi, soprattutto nel sacco vitellino. Anche i livelli misurati di colesterolo (TC) e trigliceridi (TG) erano più alti.
- Paradosso glucosio/insulina: Qui la cosa si fa interessante. Nelle larve F1 a 72 hpf, i livelli di glucosio (Glu) erano *più bassi* del controllo, mentre i livelli di insulina (INS) erano *più alti* (e aumentavano con i giorni di esposizione materna). Questo quadro ricorda l’ipoglicemia neonatale con iperinsulinemia vista anche negli umani.
- Effetti a lungo termine: E non finisce qui! Abbiamo seguito alcuni di questi pesci F1 fino all’età adulta (4 mesi). Ebbene, anche da adulti, i figli delle madri T2DM mostravano livelli di glucosio a digiuno e di insulina significativamente più alti rispetto ai controlli. Questo è un punto cruciale: l’alterazione del metabolismo glicemico e l’insulino-resistenza indotte dall’ambiente materno pre-concepimento possono persistere per tutta la vita!
Dentro i Geni: Cosa Cambia a Livello Molecolare?
Ok, abbiamo visto *cosa* succede, ma *perché*? Per capirlo, abbiamo usato la trascrittomica, una tecnica che ci permette di vedere quali geni sono più o meno “attivi” nelle larve F1 a 96 hpf.
Abbiamo trovato 167 geni espressi in modo diverso tra le larve F1 del gruppo T2DM e quelle del gruppo di controllo (57 più attivi, 110 meno attivi). Analizzando le funzioni di questi geni e le vie metaboliche in cui sono coinvolti (analisi GO e KEGG), sono emerse cose molto interessanti.
Le vie metaboliche più perturbate erano quelle legate a:
- Metabolismo degli acidi grassi (es. acido linoleico)
- Metabolismo del colesterolo
- Digestione e assorbimento dei grassi
- Via di segnalazione PPAR (un importante regolatore del metabolismo di lipidi e carboidrati)
- Metabolismo di alcuni amminoacidi (es. fenilalanina, triptofano)
- Gluconeogenesi (produzione di glucosio)
Abbiamo poi validato questi risultati con un’altra tecnica (qRT-PCR), confermando che geni chiave in queste vie erano effettivamente meno attivi nelle larve F1 da madri T2DM. Ad esempio:
- g6pca.2: Coinvolto nella produzione di glucosio (la sua riduzione potrebbe legarsi all’ipoglicemia osservata).
- Geni per il trasporto e metabolismo dei lipidi (fabp2, fabp1b.1, afp4, apoc1, apoa4b.3, cyp3c4): La loro ridotta attività potrebbe spiegare l’accumulo di grassi.
- Geni del metabolismo degli amminoacidi (gsto2, kynu, ddc, idh1): Anche gli amminoacidi sono legati al metabolismo energetico e all’insulina.
Questi risultati suggeriscono che l’iperglicemia materna prima del concepimento “programma” in modo errato l’espressione genica nella prole, portando a uno squilibrio duraturo nel modo in cui gestiscono zuccheri e grassi. L’insulino-resistenza (IR) sembra essere un fattore centrale, forse precedendo l’accumulo di lipidi o essendone una conseguenza.

Cosa Ci Insegna Tutto Questo?
Questo studio sul pesce zebra rafforza l’idea che la salute metabolica della madre *prima* della gravidanza è fondamentale per la salute futura del bambino. L’iperglicemia pre-concepimento può innescare una cascata di eventi che porta ad anomalie nello sviluppo e a disturbi persistenti del metabolismo glicolipidico nella generazione successiva.
Il fatto che questi effetti si vedano anche con la fecondazione esterna del pesce zebra suggerisce che l’alterazione avviene a livello dell’ovocita stesso, un’eredità trasmessa attraverso la linea germinale femminile.
Questo sposta l’attenzione sulla necessità di:
- Screening pre-concezionale: Identificare e gestire il diabete o l’iperglicemia nelle donne prima che cerchino una gravidanza.
- Migliorare l’ambiente gametico: Intervenire per ottimizzare la salute metabolica materna può mitigare questi effetti negativi sulla prole.
Certo, ci sono ancora domande aperte. Questi effetti si trasmettono anche alle generazioni successive (transgenerazionali)? Quali sono i meccanismi epigenetici precisi (modifiche chimiche al DNA che non cambiano la sequenza ma influenzano l’espressione genica) coinvolti? Serviranno ulteriori ricerche per capirlo.
Ma il messaggio chiave è potente: prendersi cura della propria salute metabolica non è importante solo per sé stessi, ma anche per la salute delle generazioni future, e questo inizia ancor prima del concepimento. Il piccolo pesce zebra ci ha aiutato a gettare luce su questa eredità nascosta.
Fonte: Springer