TgUAE1: L’Interruttore Segreto che Controlla la Vita (e la Morte) di Toxoplasma gondii!
Amici appassionati di scienza, oggi vi porto nel mondo microscopico ma incredibilmente complesso di un parassita che, forse senza saperlo, potreste aver incrociato: il Toxoplasma gondii. Pensate, si stima che circa un terzo della popolazione mondiale sia infettato da questo piccolo protozoo! Per la maggior parte delle persone con un sistema immunitario in forma, l’infezione passa quasi inosservata. Ma per le donne in gravidanza o per chi ha le difese immunitarie basse, la toxoplasmosi può diventare un problema serio, causando aborti, malformazioni fetali o malattie gravi.
Il guaio è che le attuali terapie contro T. gondii non sono il massimo: hanno un’efficacia limitata contro le cisti tissutali (una forma “dormiente” del parassita), possono avere effetti collaterali pesanti e altre pecche. Ecco perché noi ricercatori siamo costantemente a caccia di nuovi bersagli terapeutici, di meccanismi vitali del parassita da colpire per metterlo K.O. in modo efficace e sicuro.
Un Regista Molecolare Chiamato Ubiquitinazione
La vita di Toxoplasma gondii, come quella di ogni cellula, è finemente regolata da una miriade di processi. Tra questi, uno dei più affascinanti è l’ubiquitinazione. Immaginatela come un sistema di “etichettatura” delle proteine: una piccola proteina chiamata ubiquitina viene attaccata ad altre proteine bersaglio. Questa etichetta può significare cose diverse: “questa proteina deve essere distrutta”, “questa proteina deve cambiare attività” o “questa proteina deve spostarsi”. È un meccanismo cruciale per mantenere l’ordine e la funzionalità cellulare, un po’ come un efficiente servizio di smistamento e riciclo.
Questo processo di etichettatura avviene grazie a una cascata di tre enzimi: E1 (enzima attivatore dell’ubiquitina), E2 (enzima coniugante l’ubiquitina) e E3 (ubiquitina ligasi). L’enzima E1 è il primo della catena, quello che “carica” l’ubiquitina, preparandola per i passaggi successivi. È un po’ il “motorino d’avviamento” dell’intero sistema. Se E1 non funziona, tutto il processo di ubiquitinazione si blocca.
Alla Scoperta di TgUAE1: L’E1 Canonico di Toxoplasma
Nonostante l’importanza dell’ubiquitinazione, l’identità dell’enzima E1 principale in Toxoplasma gondii era rimasta un mistero. Certo, erano stati identificati altri enzimi simili o localizzati in organelli specifici come l’apicoplasto (una struttura unica di questi parassiti), ma l’E1 “canonico”, quello che gestisce la maggior parte del lavoro, ci sfuggiva. Fino ad ora!
Nel nostro studio, abbiamo messo sotto la lente d’ingrandimento una proteina codificata dal gene TGGT1_290290, che abbiamo battezzato TgUAE1. Utilizzando un mix di approcci – bioinformatica per analizzare la sua sequenza e struttura, biochimica per testare la sua attività in provetta, farmacologia per vedere come rispondeva a inibitori specifici, e genetica per “spegnerlo” nel parassita – abbiamo dimostrato senza ombra di dubbio che TgUAE1 è proprio lui: l’enzima E1 che stavamo cercando!
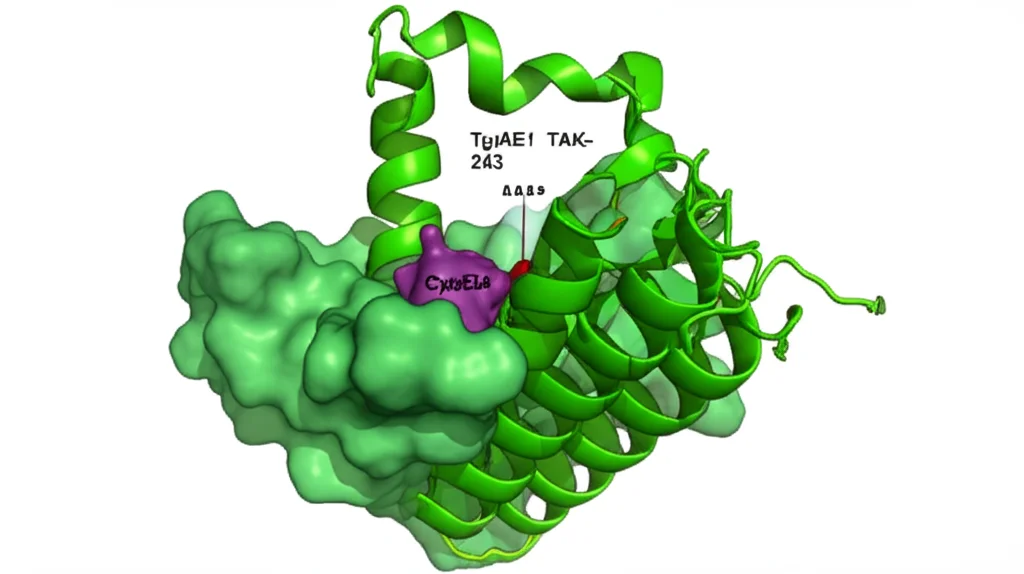
Abbiamo visto che TgUAE1 è bravissimo a formare catene di poliubiquitina, in particolare quelle legate in posizioni specifiche note come K48 (spesso un segnale di degradazione) e K63 (coinvolte in altre funzioni regolatorie). Inoltre, abbiamo identificato un composto, il TAK-243, già noto come inibitore degli enzimi UAE1 nei mammiferi e recentemente in Plasmodium falciparum (il parassita della malaria), come un efficace bloccante dell’attività di TgUAE1 anche in Toxoplasma. Esperimenti di stabilizzazione termica hanno confermato che TgUAE1 è il bersaglio intracellulare di TAK-243: in pratica, quando il farmaco si lega a TgUAE1, lo rende più stabile al calore, un chiaro segno di interazione diretta.
Cosa Succede Quando TgUAE1 Va in Tilt?
La vera domanda era: quanto è importante TgUAE1 per il parassita? Per scoprirlo, abbiamo provato a “spegnere” il gene TgUAE1. I tentativi di creare un ceppo completamente privo di TgUAE1 (knockout) sono falliti, suggerendo che questo enzima è essenziale per la sopravvivenza del parassita. Non è una sorpresa, visto che il suo “punteggio fenotipico CRISPR” (una misura di quanto un gene sia cruciale) era molto basso (-4.25), indicando un ruolo vitale.
Allora abbiamo optato per un approccio più “soft”: un ceppo “knockdown” (cKD-TgUAE1), in cui potevamo ridurre l’espressione di TgUAE1 a comando usando un induttore chimico (l’anidrotetraciclina, ATc). I risultati sono stati drastici! Quando i livelli di TgUAE1 venivano abbassati:
- Il ciclo litico del parassita era severamente compromesso. Il ciclo litico è la sequenza di eventi con cui Toxoplasma invade una cellula ospite, si moltiplica al suo interno e poi fuoriesce distruggendo la cellula per infettarne altre. Senza abbastanza TgUAE1, i parassiti formavano placche (aree di distruzione cellulare) molto più piccole o non le formavano affatto.
- L’omeostasi del parassita, cioè il suo equilibrio interno, andava in tilt.
- Specifiche fasi del ciclo litico erano colpite: la capacità di movimento (gliding), l’invasione delle cellule ospiti, la proliferazione intracellulare e la capacità di fuoriuscire (egress) erano tutte ridotte.
Per essere sicuri che questi effetti fossero dovuti proprio all’attività enzimatica di TgUAE1, abbiamo creato un ceppo mutante in cui un amminoacido cruciale nel sito attivo dell’enzima, la cisteina 634 (Cys634), era stato sostituito. Questa mutazione (TgUAE1C634S) rendeva l’enzima cataliticamente “morto” o quasi. Ebbene, anche questo mutante mostrava difetti significativi, in particolare nella proliferazione e nel movimento, confermando che l’attività enzimatica di TgUAE1 è fondamentale.
Un Effetto Domino: Mitocondri e Stress Cellulare
Andando più a fondo, abbiamo osservato che la carenza di TgUAE1 o la sua inattivazione catalitica causavano gravi problemi ai mitocondri del parassita, le sue centrali energetiche. Normalmente i mitocondri hanno una forma ad anello o a spermatozoo; in assenza di TgUAE1 funzionante, apparivano frammentati e deformi. Curiosamente, l’apicoplasto, un altro organello vitale, non sembrava risentirne più di tanto, distinguendo TgUAE1 da altri E1 specifici dell’apicoplasto precedentemente identificati.
Ma non è tutto. Analizzando il trascrittoma (l’insieme degli RNA messaggeri, che ci dice quali geni sono attivi) e il proteoma dell’ubiquitina (quali proteine sono ubiquitinate e dove), abbiamo scoperto un vero e proprio sconvolgimento. La deplezione di TgUAE1 portava a:
- Una riduzione generale dei livelli di ubiquitinazione, incluse le catene K48 e K63.
- Cambiamenti nell’espressione di centinaia di geni (940 geni differenzialmente espressi!). Molti di questi erano coinvolti in funzioni cellulari chiave come il legame all’ATP, l’attività chinasica, il movimento basato sui microtubuli e processi di ossido-riduzione.
- Un’attivazione di geni legati allo stress del reticolo endoplasmatico (ER). L’ER è un organello coinvolto nella sintesi e nel corretto ripiegamento delle proteine. Se le proteine non si ripiegano bene (cosa che può succedere se il sistema di ubiquitinazione e degradazione non funziona a dovere), l’ER va in stress. Questo stress, a sua volta, sembrava indurre il parassita a tentare una transizione verso lo stadio di bradizoita (la forma cistica, dormiente), come suggerito dall’aumento di antigeni specifici dei bradizoiti.
L’analisi proteomica ha rivelato che le proteine differenzialmente espresse o ubiquitinate erano arricchite in organelli come i ribosomi (fabbriche di proteine), i granuli densi e le roptrie (organelli secretori cruciali per l’invasione e la manipolazione della cellula ospite). Questo suggerisce che TgUAE1 influenza la biologia di Toxoplasma agendo sia sulla sintesi che sulla degradazione delle proteine, mantenendo l’equilibrio in queste strutture vitali.
Perché TgUAE1 è un Bersaglio Interessante?
Questa scoperta è entusiasmante per diversi motivi. Innanzitutto, ci aiuta a capire molto meglio come funziona questo parassita così diffuso e, in certi casi, pericoloso. TgUAE1 si è rivelato un regolatore chiave non solo dell’ubiquitinazione, ma di un’ampia rete di espressione genica che governa il ciclo litico e l’omeostasi del parassita.
In secondo luogo, identificare un enzima così cruciale apre la strada allo sviluppo di nuove strategie terapeutiche. Sebbene l’inibitore TAK-243 abbia mostrato un indice terapeutico (il rapporto tra tossicità per le cellule ospiti ed efficacia contro il parassita) piuttosto basso nel nostro studio (1.15), il che significa che la dose efficace per il parassita è vicina a quella tossica per l’ospite, la sua capacità di inibire TgUAE1 in Toxoplasma è un’informazione preziosa. Potrebbe essere un punto di partenza per sviluppare inibitori più specifici per la versione parassitaria dell’enzima o per strategie di terapia combinata.
Certo, TgUAE1 è un enzima conservato in molti eucarioti, compresi noi umani. La sfida sarà trovare un modo per colpire selettivamente la versione del parassita. Tuttavia, le differenze nel sistema dell’ubiquitina tra Toxoplasma e i mammiferi (ad esempio, i proteasomi di Toxoplasma sono solo citoplasmatici, mentre nei mammiferi sono anche nucleari) potrebbero offrire delle finestre di opportunità.
In conclusione, il nostro viaggio nel cuore molecolare di Toxoplasma gondii ci ha permesso di svelare il ruolo indispensabile di TgUAE1. È come aver trovato uno degli interruttori principali nel quadro di comando del parassita. Ora la sfida è capire come “spegnere” questo interruttore in modo selettivo per combattere la toxoplasmosi, senza fare troppi danni al “quadro di comando” delle nostre cellule. La ricerca continua, e ogni scoperta come questa ci avvicina un po’ di più all’obiettivo!
Fonte: Springer







