Respirare di Nuovo: Come EIT, Posizione Prona e Ossido Nitrico Hanno Rivoluzionato un Caso Complesso di Trapianto Polmonare
Ciao a tutti! Oggi voglio raccontarvi una storia incredibile che arriva direttamente dalla frontiera della medicina intensiva, un caso che dimostra come l’innovazione e un approccio personalizzato possano fare davvero la differenza tra la vita e la morte. Parliamo di trapianti polmonari, procedure salvavita per chi soffre di malattie respiratorie allo stadio terminale, ma che purtroppo possono portare a complicazioni serie. Una delle più temute è la Disfunzione Primaria dell’Innesto (PGD), in particolare quella di Grado 3, la forma più severa.
La Sfida: Quando i Nuovi Polmoni Faticano a Partire
Immaginate la scena: un paziente ha appena ricevuto due nuovi polmoni, un’operazione complessa e delicata. Tutti sperano nel meglio, ma a volte, entro le prime 72 ore, qualcosa va storto. I nuovi polmoni non funzionano come dovrebbero, si sviluppa un’infiammazione acuta e il paziente entra in una condizione chiamata PGD. La PGD di Grado 3 è particolarmente grave: l’ossigenazione del sangue crolla drasticamente (quella che chiamiamo ipossiemia refrattaria), mettendo a rischio la vita del paziente e complicando enormemente la gestione post-operatoria. Aumenta il rischio di complicazioni acute e croniche e, purtroppo, anche la mortalità.
Nel caso specifico che voglio condividere, ci siamo trovati proprio di fronte a questa situazione critica. Una paziente di 54 anni, operata per una fibrosi polmonare interstiziale, sviluppa una PGD 3 dopo il trapianto bilaterale. Nonostante il supporto della circolazione extracorporea (ECMO), una macchina che aiuta a ossigenare il sangue quando i polmoni non ce la fanno, i suoi livelli di ossigeno nel sangue (la famosa PaO₂) restavano pericolosamente bassi, intorno ai 71.7 mmHg al quarto giorno post-operatorio. Questo significava che non potevamo assolutamente pensare di staccarla dall’ECMO in sicurezza. Serviva una strategia diversa, più mirata.
Entra in Scena l’EIT: Vedere Dentro i Polmoni in Tempo Reale
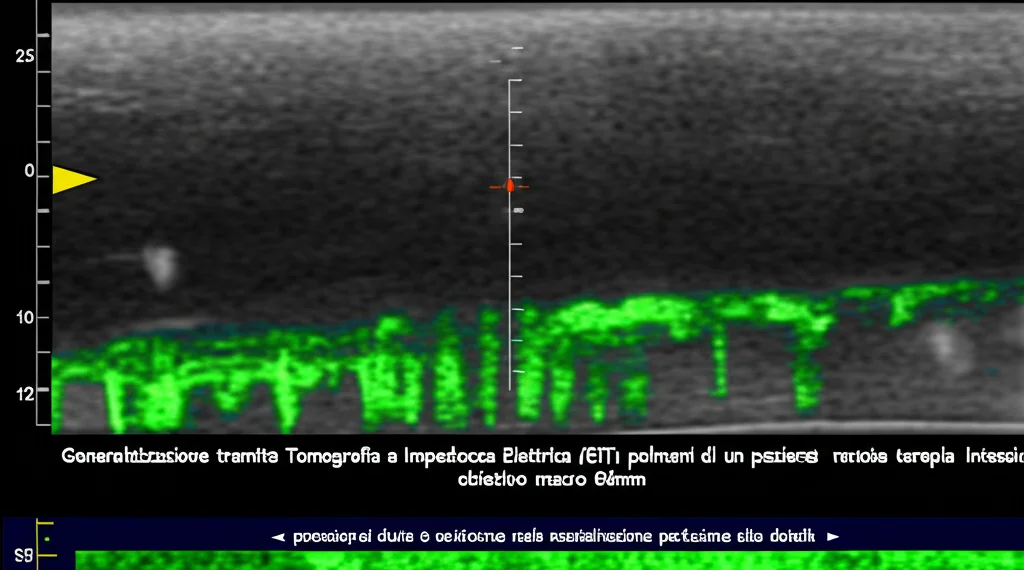
Qui entra in gioco una tecnologia affascinante: la Tomografia a Impedenza Elettrica (EIT). Pensatela come una sorta di “ecografia elettrica” dei polmoni. Non usa radiazioni, ma applica delle piccole correnti elettriche (innocue!) tramite elettrodi posti sul torace del paziente. Misurando come queste correnti attraversano i tessuti, l’EIT crea mappe dinamiche che ci mostrano, istante per istante, come l’aria (ventilazione) e il sangue (perfusione) si distribuiscono nelle diverse regioni polmonari.
Perché è così importante? Perché ci permette di “vedere” cosa non funziona. Magari l’aria arriva bene in una zona, ma lì non c’è abbastanza flusso sanguigno per catturare l’ossigeno, o viceversa. Tradizionalmente, ci si basa su esami come radiografie, TAC e analisi del sangue, interpretando i dati con la nostra esperienza clinica. L’EIT aggiunge un livello di dettaglio incredibile, visualizzando in tempo reale le dinamiche respiratorie. È come avere una finestra aperta sui polmoni del paziente, permettendoci di personalizzare le terapie in modo molto più preciso. Ad esempio, l’EIT è già usata per ottimizzare la pressione positiva di fine espirazione (PEEP) nel ventilatore o per gestire la ventilazione a polmone singolo durante certi interventi chirurgici.
Primo Tentativo Guidato dall’EIT: La Posizione Prona
Di fronte all’ipossiemia persistente della nostra paziente, e con i dati dell’EIT che mostravano una distribuzione non uniforme della ventilazione (il centro della ventilazione era spostato verso la parte dorsale), abbiamo deciso di provare la posizione prona. Mettere il paziente a pancia in giù è una strategia ben nota e validata per la sindrome da distress respiratorio acuto (ARDS), perché sfrutta la gravità per migliorare la distribuzione della ventilazione e del flusso sanguigno, specialmente nelle zone posteriori dei polmoni che spesso collassano in posizione supina. Inoltre, aiuta a drenare le secrezioni.
Abbiamo quindi girato la paziente, monitorando costantemente con l’EIT. La prima sessione è durata 22 ore. E i risultati? L’ossigenazione è migliorata durante la pronazione! L’EIT ha confermato che la distribuzione del volume corrente era più omogenea. Tuttavia, c’era ancora un problema: il rapporto tra ventilazione e perfusione (il famoso V/Q mismatch) non era ottimale. E, cosa frustrante, appena riportavamo la paziente in posizione supina, l’ossigenazione peggiorava di nuovo. La posizione prona aiutava, ma non era la soluzione definitiva. L’EIT ci diceva che, sebbene la ventilazione fosse migliorata, la perfusione in quelle aree non era ancora adeguata.
La Svolta: Aggiungere l’Ossido Nitrico Inalatorio (iNO)
Era il sesto giorno post-operatorio. La paziente dipendeva ancora pesantemente dall’ECMO, l’ipossiemia era refrattaria. L’EIT ci suggeriva che il problema principale era ora un marcato V/Q mismatch. Cosa fare? Abbiamo deciso di aggiungere un’altra arma al nostro arsenale: l’ossido nitrico inalatorio (iNO).
L’iNO è un gas che, quando inalato, agisce come un potente vasodilatatore selettivo a livello polmonare. Significa che dilata i vasi sanguigni solo nelle aree ben ventilate dei polmoni, deviando il flusso sanguigno lontano dalle zone mal ventilate e dirigendolo dove può effettivamente caricarsi di ossigeno. È una terapia usata per l’ipertensione polmonare e l’ipossiemia refrattaria, proprio il nostro caso.
Abbiamo iniziato la somministrazione di iNO a una concentrazione di 20 ppm. E qui è avvenuta la magia. Dopo solo sei ore, i risultati delle analisi del sangue erano nettamente migliorati: la PaO₂ era salita a 119 mmHg (ricordate che era partita da circa 70-80 mmHg?) con la stessa impostazione del ventilatore! L’EIT ha confermato visivamente quello che vedevamo nei numeri: il rapporto ventilazione-perfusione era significativamente ottimizzato (l’indice GI, che misura l’inomogeneità globale, era migliorato). La circolazione era stabile, i polmoni apparivano più “puliti” all’imaging.
Verso la Guarigione: Un Percorso Complicato ma Vincente
Questa combinazione di strategie, guidata passo dopo passo dall’EIT, si è rivelata vincente. Al decimo giorno post-operatorio, la situazione era abbastanza stabile da permetterci, dopo attenta valutazione, di rimuovere finalmente l’ECMO. L’EIT mostrava parametri incoraggianti (LHI: 80, GI: 63), indicando un buon accoppiamento ventilazione-perfusione.
Certo, il percorso non è stato tutto in discesa. Durante il recupero, abbiamo dovuto affrontare infezioni batteriche resistenti (Acinetobacter baumannii e Pseudomonas aeruginosa pan-resistenti), che probabilmente contribuivano all’ipossiemia iniziale. Questo ha richiesto aggiustamenti della terapia antibiotica. Data la difficoltà a staccare la paziente dal ventilatore e la necessità di gestire le secrezioni, abbiamo optato per una tracheotomia il giorno successivo alla rimozione dell’ECMO.
Ma da lì in poi, le cose hanno iniziato a migliorare costantemente. Le secrezioni si sono ridotte, l’edema delle mucose bronchiali è migliorato, gli indici di infezione sono scesi. Abbiamo potuto ridurre gradualmente il supporto ventilatorio. Al 24° giorno post-operatorio, la paziente è stata trasferita fuori dalla terapia intensiva. E, finalmente, 52 giorni dopo l’intervento, è stata svezzata dal ventilatore e la cannula tracheostomica è stata rimossa. Un successo straordinario!
Cosa Abbiamo Imparato?
Questo caso è emblematico. Ci mostra come la PGD 3 post-trapianto sia una bestia nera, ma non invincibile. L’uso combinato e ragionato di:
- Monitoraggio avanzato con EIT: per capire *dove* e *perché* l’ossigenazione fallisce e per guidare le terapie in tempo reale. L’EIT ci ha permesso di passare da un approccio empirico a una gestione respiratoria “visiva” e personalizzata. Abbiamo usato la tecnica basata sulla pulsatilità cardiaca per valutare la perfusione, evitando le problematiche legate all’iniezione di soluzione salina ipertonica in pazienti con ECMO.
- Posizione prona ottimizzata: non solo applicata, ma valutata nella sua efficacia specifica sul V/Q mismatch grazie all’EIT.
- Terapia con iNO: introdotta come misura mirata per correggere il V/Q mismatch residuo, con un impatto decisivo sull’ossigenazione. Interessante notare anche i potenziali effetti benefici dell’NO contro alcuni patogeni polmonari e sull’infiammazione, come suggerito da studi preclinici.
Questa strategia integrata ha offerto un approccio innovativo e, in questo caso, salvavita. Sottolinea il ruolo promettente dell’EIT nella valutazione continua e nella gestione individualizzata dei pazienti più critici. Certo, servono studi più ampi per confermare questi risultati, ma la strada verso una gestione respiratoria sempre più precisa e visiva è decisamente aperta. Ed è una strada entusiasmante da percorrere!
Fonte: Springer