EGFR Amplificato: Il Motore Segreto delle Metastasi Cerebrali nel Tumore al Polmone?
Ciao a tutti! Oggi voglio parlarvi di un argomento tanto complesso quanto cruciale nella lotta contro il cancro: le metastasi cerebrali, in particolare quelle che originano dal tumore al polmone non a piccole cellule (NSCLC). Sapete, quando un tumore decide di “viaggiare” e formare nuove colonie in organi distanti, la situazione si complica parecchio, e il cervello, purtroppo, è una meta fin troppo comune per le cellule tumorali polmonari. La prognosi, in questi casi, non è delle migliori. Ma la scienza non si ferma, e oggi voglio condividere con voi alcune scoperte affascinanti che potrebbero aprire nuove strade terapeutiche.
Il Dramma delle Metastasi Cerebrali
Partiamo da un dato: le metastasi cerebrali (BM) sono un bel problema. Non solo peggiorano drasticamente la qualità della vita dei pazienti, ma accorciano anche le aspettative di sopravvivenza. Pensate che, secondo studi passati, quasi il 20% dei pazienti con cancro al polmone sviluppa metastasi al cervello. Le terapie attuali, come chirurgia, radioterapia (spesso su tutto il cervello, la WBRT) e chemioterapia, offrono un aiuto, ma spesso limitato nel tempo. Anche le terapie mirate e l’immunoterapia, pur rappresentando grandi passi avanti, faticano a essere risolutive in questo contesto. La sopravvivenza mediana, anche con WBRT, si aggira sui 3-6 mesi, e a un anno è solo del 10-20%. C’è un bisogno disperato di capire *perché* queste cellule tumorali riescono a raggiungere e colonizzare il cervello, per poterle fermare.
La Nostra Indagine: A Caccia di Indizi Genetici
Proprio per cercare di svelare questi meccanismi, abbiamo intrapreso uno studio, i cui risultati sono stati recentemente pubblicati. Tra il 2019 e il 2023, abbiamo coinvolto pazienti con tumore al polmone e pazienti che, purtroppo, avevano già sviluppato metastasi cerebrali da NSCLC. Cosa abbiamo fatto? Abbiamo preso campioni di tessuto sia dal tumore polmonare primario sia dalle metastasi cerebrali chirurgicamente rimosse e li abbiamo analizzati con una tecnica potentissima chiamata Next-Generation Sequencing (NGS). L’obiettivo era confrontare il profilo genetico dei due tipi di tumore nello stesso paziente (o comunque tra i due gruppi) per scovare le differenze chiave che potessero spiegare la capacità di metastatizzare al cervello.
La Sorpresa: Il Ruolo dell’Amplificazione di EGFR
E qui arriva il bello. Confrontando i dati NGS, una differenza è saltata subito all’occhio: l’amplificazione del gene EGFR. Cosa significa “amplificazione”? Semplicemente, che le cellule tumorali presentano molte più copie di questo gene rispetto al normale. Ebbene, abbiamo trovato che questa amplificazione era significativamente più frequente nei pazienti con metastasi cerebrali (ben il 40%) rispetto ai pazienti con solo tumore al polmone (12%). Questo dato era già un campanello d’allarme. Analizzando dati pubblici, abbiamo anche visto che i pazienti con adenocarcinoma polmonare e amplificazione di EGFR tendono ad avere una prognosi peggiore. Sembrava proprio che avere “troppo EGFR” potesse essere un fattore trainante per la diffusione del tumore al cervello. Oltre a EGFR, abbiamo notato che la mutazione del gene TP53 era molto comune (60%) nei tessuti metastatici cerebrali.
Dalla Genetica alla Biologia: Esperimenti in Laboratorio
Ma un’associazione statistica non basta, volevamo capire *come* l’eccesso di EGFR potesse favorire le metastasi. Per farlo, siamo passati al laboratorio. Abbiamo preso una linea cellulare di cancro al polmone nota come PC9 (che ha già una mutazione attivante di EGFR, comune in NSCLC) e l’abbiamo modificata geneticamente per farle produrre quantità ancora maggiori della proteina EGFR, mimando così l’amplificazione vista nei pazienti. Abbiamo chiamato queste cellule “EGFR-overexpressing” e le abbiamo confrontate con le cellule PC9 “normali” (parentali).
I risultati sono stati chiari:
- Proliferazione: Le cellule con più EGFR crescevano più velocemente (test CCK-8).
- Migrazione: Erano più brave a “muoversi” e a chiudere una “ferita” creata artificialmente in una piastra di coltura (wound healing assay).
- Invasione: Riuscivano a passare più facilmente attraverso una membrana porosa, simulando la capacità di invadere i tessuti (transwell assay).
Insomma, l’eccesso di EGFR sembrava dare alle cellule tumorali una marcia in più, rendendole più aggressive e mobili.
La Prova del Nove: Il Modello Animale
Il passo successivo era verificare se questo succedeva anche in un organismo complesso. Abbiamo quindi utilizzato dei topi come modello. Abbiamo iniettato le cellule PC9 (sia quelle normali che quelle con EGFR potenziato, entrambe modificate per emettere luce così da poterle tracciare) direttamente nel cuore dei topi. Questa tecnica permette alle cellule tumorali di viaggiare nel flusso sanguigno e raggiungere vari organi, cervello compreso, mimando il processo metastatico. Usando una speciale telecamera in grado di rilevare la luce emessa dalle cellule (bioluminescenza), abbiamo monitorato settimanalmente la formazione di metastasi cerebrali.
Il risultato? Impressionante. I topi che avevano ricevuto le cellule con EGFR amplificato hanno sviluppato metastasi cerebrali con una frequenza significativamente maggiore rispetto ai topi del gruppo di controllo (quelli con cellule PC9 normali). Era la conferma che cercavamo: l’amplificazione di EGFR non solo rende le cellule più aggressive *in vitro*, ma promuove attivamente la formazione di metastasi cerebrali *in vivo*.
Ma Qual è il Meccanismo? L’Indizio dell’Adesione Cellulare
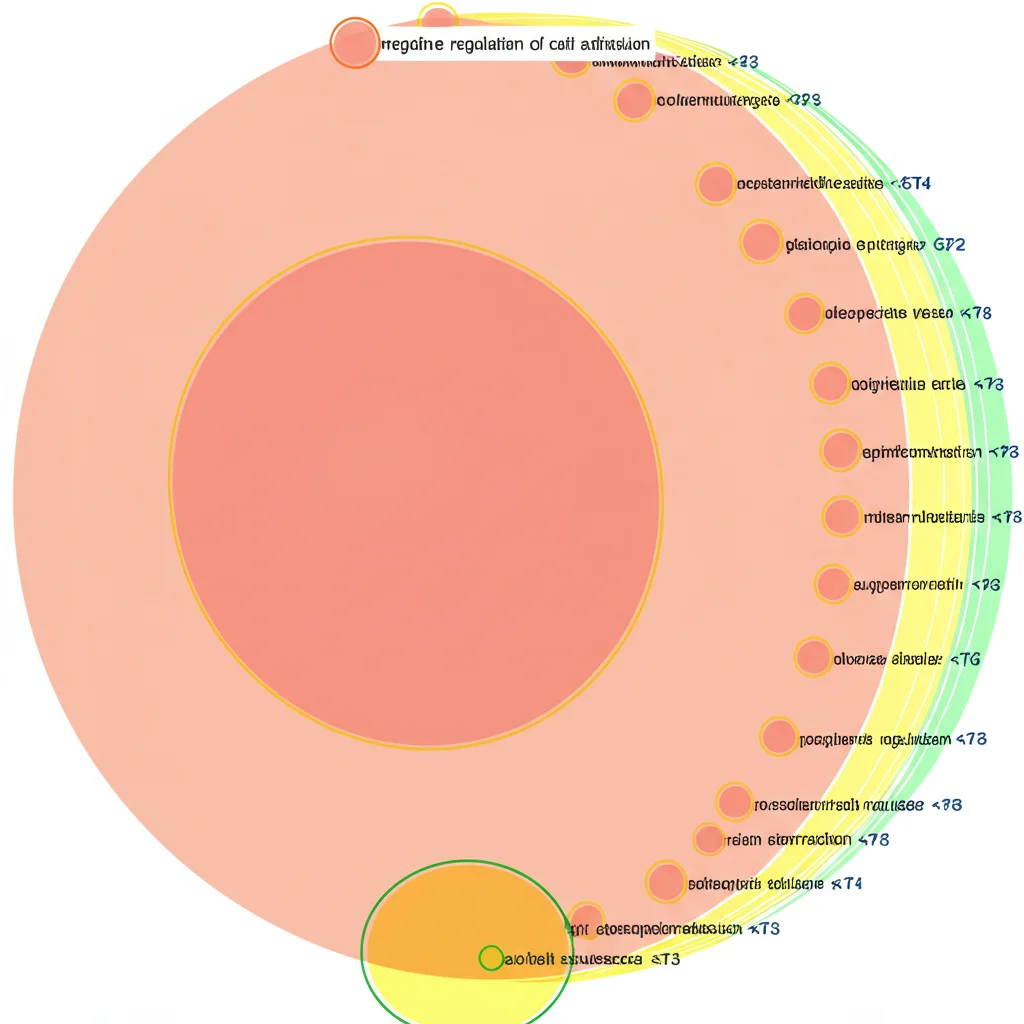
Ok, EGFR amplificato spinge le metastasi cerebrali. Ma *come*? Per capirlo, siamo tornati alle nostre cellule in laboratorio e abbiamo fatto un’analisi ancora più approfondita: il sequenziamento dell’RNA (RNA-Seq). Questa tecnica ci permette di vedere quali geni sono più o meno “accesi” (espressi) nelle cellule con EGFR potenziato rispetto a quelle normali. Abbiamo identificato un bel po’ di geni con espressione diversa (Differentially Expressed Genes, DEGs).
Ma la vera illuminazione è arrivata quando abbiamo usato l’analisi di Gene Ontology (GO). Questo strumento ci aiuta a capire quali *funzioni biologiche* o *componenti cellulari* sono associate ai geni che abbiamo trovato alterati. Ebbene, tra i processi biologici (BP), un termine spiccava: “negative regulation of cell adhesion“, ovvero la regolazione negativa dell’adesione cellulare. In parole povere, sembra che l’eccesso di EGFR porti le cellule a “tenersi meno strette” tra loro e alla matrice extracellulare che le circonda. Per una cellula tumorale che vuole metastatizzare, questa è una capacità fondamentale: deve potersi staccare dal tumore primario, viaggiare nel sangue e poi attaccarsi nel nuovo organo. Una ridotta adesione facilita proprio il primo passo, il distacco. Altri termini arricchiti riguardavano lo sviluppo della pelle/epidermide e, per le componenti cellulari (CC), la matrice extracellulare contenente collagene e la membrana plasmatica.
Tra i geni specifici la cui espressione cambiava, abbiamo notato LGALS1, che codifica per la galectina-1. Ricerche precedenti hanno associato alti livelli di LGALS1 a una prognosi sfavorevole in diversi tipi di tumore, suggerendo che potrebbe essere un attore importante in questo processo di ridotta adesione e aumentata aggressività.
Cosa Significa Tutto Questo?
Mettendo insieme i pezzi, emerge un quadro affascinante: nei pazienti con NSCLC, l’amplificazione del gene EGFR sembra essere un fattore chiave che spinge le cellule tumorali a diventare metastatiche, in particolare verso il cervello. Questo processo sembra mediato, almeno in parte, da una riduzione della capacità delle cellule di aderire tra loro e all’ambiente circostante, rendendole più libere di “scappare” e viaggiare.
Certo, la ricerca non finisce qui. Dobbiamo capire meglio i dettagli molecolari di questo meccanismo. Qual è esattamente il legame tra EGFR e la regolazione dell’adesione? Che ruolo gioca specificamente LGALS1? Come interagiscono questi fattori? Sono domande a cui dovremo rispondere con studi futuri. Inoltre, il nostro studio ha delle limitazioni, come la necessità di validare ulteriormente il ruolo di LGALS1.
Tuttavia, questi risultati sono estremamente promettenti. Identificare l’amplificazione di EGFR come un “driver” delle metastasi cerebrali apre la porta a nuove strategie terapeutiche. Forse, in futuro, potremmo usare farmaci che bloccano specificamente l’attività di EGFR (alcuni già esistono, ma potrebbero essere usati in modo più mirato in questo contesto) o che intervengono sui meccanismi di adesione cellulare per prevenire o trattare più efficacemente le metastasi cerebrali nei pazienti con NSCLC e amplificazione di EGFR. È una speranza concreta per migliorare la prognosi di questi pazienti. La strada è ancora lunga, ma ogni scoperta ci avvicina un po’ di più all’obiettivo.
Fonte: Springer