SO2: Il Nemico Nascosto delle Superleghe? Scopriamo la Corrosione a Lungo Termine della K452
Ciao a tutti, appassionati di scienza e tecnologia! Oggi voglio portarvi con me in un viaggio affascinante nel mondo dei materiali avanzati, in particolare delle superleghe a base di nichel. Questi materiali sono dei veri e propri campioni di resistenza, indispensabili per componenti che devono sopportare condizioni estreme, come le pale delle turbine a gas. Immaginate temperature altissime, stress meccanici notevoli e ambienti chimicamente aggressivi. Un vero inferno, no?
E parlando di ambienti aggressivi, c’è un nemico subdolo che sta diventando sempre più rilevante: lo zolfo, o meglio, il biossido di zolfo (SO2). Con l’uso crescente di biocarburanti, come il biogas, i gas di scarico delle turbine si arricchiscono di questo composto. E indovinate un po’? L’SO2 non fa affatto bene ai nostri materiali high-tech. Accelera il loro degrado, riduce l’efficienza delle turbine e fa lievitare i costi di manutenzione.
Per questo motivo, ho deciso di approfondire l’effetto dell’SO2 su una specifica superlega, la K452, nota per il suo alto contenuto di cromo che dovrebbe renderla più resistente. Ma lo è davvero sul lungo periodo, quando esposta a SO2? Parliamo di migliaia di ore di servizio! La letteratura scientifica si è concentrata molto sulla solfurazione a breve termine (meno di 500 ore) o sull’effetto della composizione della lega, ma cosa succede dopo 1000, 2000 ore in un ambiente realistico? E come fa esattamente lo zolfo a “infiltrarsi” e a danneggiare la lega? C’è ancora molto da capire.
L’Esperimento: K452 Sotto Torchio
Quindi, cosa abbiamo fatto? Abbiamo preso dei campioni di questa superlega K452, che dopo un trattamento termico standard si presenta con una bella microstruttura fatta di grani, una fase chiamata gamma primo (γ‘) che le dà resistenza, carburi e strutture eutettiche. L’abbiamo esposta a un ambiente che simula quello di una turbina a gas alimentata con combustibili “sporchi”: aria con il 2% di SO2, alla bellezza di 900°C, per un tempo lunghissimo, fino a 2000 ore (quasi tre mesi!). Ovviamente, per capire bene l’effetto dell’SO2, abbiamo fatto lo stesso test in aria “pulita”, senza SO2, come confronto. Abbiamo misurato l’aumento di peso dei campioni nel tempo (un classico indicatore di corrosione) e poi siamo andati a vedere da vicino cosa era successo alla microstruttura, sia in superficie che in sezione. E non ci siamo fermati qui: abbiamo usato anche calcoli di dinamica molecolare (MD) per simulare come lo zolfo interagisce con la lega a livello atomico. Insomma, un’indagine a tutto tondo!
Cosa Succede nel Tempo? La Bilancia Non Mente
I risultati dell’aumento di massa sono stati chiarissimi fin da subito. La presenza di SO2 fa una differenza enorme! Dopo 2000 ore, i campioni esposti all’ambiente con SO2 avevano guadagnato in media 6.64 mg/cm², mentre quelli in aria normale solo 4.12 mg/cm². Un aumento di oltre il 60%! Questo ci dice subito che l’SO2 accelera notevolmente la corrosione.
Abbiamo anche analizzato la cinetica, cioè come l’aumento di peso cambia nel tempo. C’è un parametro, chiamato ‘n’, che ci dice se il processo è controllato dalla diffusione (n vicino a 2, tipico di uno strato protettivo compatto) o se lo strato è meno integro (n vicino a 1). Bene, in presenza di SO2, il valore di ‘n’ era 1.79, mentre senza SO2 era 1.99. Questo suggerisce che lo strato di corrosione che si forma con l’SO2 è meno protettivo, meno compatto, e lascia passare più facilmente le specie corrosive.

Uno Sguardo alla Superficie: Buchi e Crateri
E andando a vedere la superficie al microscopio elettronico a scansione (SEM), abbiamo capito perché lo strato è meno protettivo. Mentre in aria normale si forma uno strato di corrosione relativamente compatto (principalmente ossidi di cromo e titanio), in presenza di SO2 la storia cambia drasticamente. Dopo 1000 ore iniziano a comparire delle vaiolature (pits), dei veri e propri buchi nello strato protettivo. E dopo 2000 ore, questi crateri sono diffusi, interconnessi e distruggono l’integrità dello strato superficiale! Abbiamo usato anche l’interferometria a luce bianca (WLI) per mappare la topografia 3D: la differenza di altezza tra la cima dello strato e il fondo dei crateri arrivava fino a 37.4 µm con SO2, contro soli 6.5 µm senza. Una differenza abissale! L’SO2, quindi, non crea solo qualche difetto isolato, ma compromette seriamente tutta la barriera protettiva.
Scavando più a Fondo: Cosa C’è Sotto?
Analizzando la sezione trasversale dei campioni, abbiamo scoperto altri dettagli cruciali. In entrambi gli ambienti si forma uno strato esterno ricco di ossido di cromo (Cr2O3) e ossido di titanio (TiO2), con delle “radici” di ossido di alluminio (Al2O3) che crescono verso l’interno. Ma con l’SO2 succedono due cose particolari:
- Compaiono fasi bianche nello strato di corrosione, sia esternamente che internamente, specialmente dopo tempi lunghi (1000-2000 ore).
- Si formano numerosi vuoti all’interno dello strato.
Grazie all’analisi elementare (EDS ed EPMA) e alla diffrazione a raggi X (XRD), abbiamo identificato queste fasi bianche: esternamente si tratta di ossido di nichel (NiO), mentre internamente, spesso attorno ai vuoti, troviamo solfuri ricchi di nichel (NiS). È importante notare che NiO e NiS compaiono solo in presenza di SO2!
Un’altra scoperta fondamentale riguarda il nichel (Ni). Nei campioni esposti a SO2, abbiamo osservato un chiaro arricchimento di nichel nello strato di corrosione esterno. Questo significa che il nichel sta diffondendo dal cuore della lega (il substrato) verso la superficie esterna. Questo fenomeno è molto meno pronunciato, o assente, nei campioni senza SO2. La diffrazione XRD ha anche mostrato uno spostamento dei picchi della matrice γ/γ’, indicando un aumento del parametro reticolare, coerente con l’uscita di atomi di Ni dal substrato.

Perché l’SO2 Fa Così Male? Sveliamo i Meccanismi
Ok, abbiamo visto cosa succede, ma perché succede? Qui entrano in gioco la termodinamica e la dinamica molecolare.
1. Questione di Potenziale Chimico: Abbiamo calcolato il potenziale chimico totale dell’ambiente gassoso con e senza SO2. Risultato? L’aggiunta di SO2 aumenta il potenziale chimico totale. Questo crea un “gradiente” più forte tra l’ambiente e la lega, una sorta di “spinta” maggiore che accelera la diffusione delle molecole gassose verso la superficie e, di conseguenza, la corrosione.
2. La Danza di Ossidi e Solfuri: A 900°C, in presenza di O2 e SO2, possono formarsi vari composti. I diagrammi di stabilità termodinamica ci dicono che gli ossidi (Cr2O3, Al2O3, TiO2) sono generalmente più stabili. Tuttavia, il nichel ha una certa tendenza a formare solfuri (NiS) anche a pressioni parziali di ossigeno relativamente alte, più facilmente rispetto a cromo, titanio o alluminio. Questo spiega perché troviamo NiS nei nostri campioni.
3. La Fuga del Nichel: La presenza di SO2 e la formazione iniziale di solfuri (che hanno più difetti degli ossidi e permettono una diffusione atomica più rapida) accelerano la “consumazione” degli elementi come Cr e Al vicino alla superficie. Questo aumenta il gradiente di potenziale chimico tra substrato e strato corroso. Secondo alcuni modelli, questo forte gradiente può cambiare il meccanismo di diffusione del nichel, facendolo muovere più velocemente verso l’esterno attraverso “canali” all’interno dello strato di corrosione (forse i difetti stessi, come i bordi grano o i vuoti nascenti), invece che solo lungo l’interfaccia. Ecco spiegato l’arricchimento di Ni nello strato esterno!
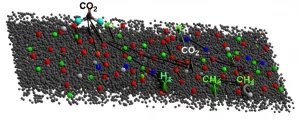
4. L’Intrusione dello Zolfo (Simulazioni MD): Come fa lo zolfo a penetrare? Le nostre simulazioni di dinamica molecolare hanno mostrato che la molecola di SO2 ha un’energia di adsorbimento sulla superficie di nichel (Ni(111)) più bassa rispetto all’ossigeno (O2) e persino all’atomo di zolfo (S) stesso. Questo significa che l’SO2 tende ad “attaccarsi” più facilmente ai siti attivi sulla superficie del nichel, specialmente all’inizio. A lungo termine, però, quando si è formato uno strato di ossido, è più probabile che le molecole di SO2 si infiltrino attraverso i difetti (vuoti, microcricche) presenti nello strato stesso.
5. Il Ciclo Infernale (Meccanismo a Lungo Termine): Mettendo insieme tutti i pezzi, proponiamo un meccanismo di corrosione a lungo termine in tre fasi:
- Stadio I (< 100 h): Formazione iniziale di ossidi protettivi, ma anche di alcuni solfuri (specialmente NiS) sulla superficie a causa dell’adsorbimento preferenziale di SO2.
- Stadio II (100-1000 h): Crescita dello strato di Cr2O3/TiO2. L’SO2 inizia a dissolversi e/o a penetrare attraverso i difetti. La formazione di solfuri accelera la diffusione degli elementi, aumenta il gradiente chimico e promuove la diffusione verso l’esterno del Ni.
- Stadio III (> 1000 h): Questo è lo stadio critico! L’arricchimento di Ni nello strato esterno e la continua infiltrazione di SO2 accelerano la formazione di NiS. Questi solfuri di nichel hanno punti di fusione relativamente bassi e possono volatilizzarsi. Quando incontrano zone con più ossigeno (più vicine alla superficie), si ossidano formando NiO poroso e rilasciando zolfo (S2). Questo zolfo liberato può diffondere di nuovo verso l’interno, reagire con altro Ni e ricominciare il ciclo (solfurazione -> ossidazione -> rilascio di S -> nuova solfurazione). Questo ciclo ripetuto crea sempre più vuoti, rende lo strato sempre meno protettivo, facilita l’ingresso di O2 e SO2 e porta alla formazione dei crateri che abbiamo osservato. Ecco perché la velocità di corrosione aumenta così tanto nel lungo periodo in presenza di SO2!
Al contrario, senza SO2, si forma uno strato di ossido più compatto e stabile. La corrosione rallenta nel tempo perché lo strato stesso diventa una barriera efficace alla diffusione dell’ossigeno.

Conclusioni: Cosa Portiamo a Casa?
Questa indagine ci ha mostrato in modo chiaro e dettagliato come la presenza di SO2, anche solo al 2%, possa peggiorare drasticamente la resistenza alla corrosione ad alta temperatura della superlega K452 sul lungo periodo (fino a 2000 ore). Il meccanismo chiave è un ciclo vizioso di solfurazione e ossidazione del nichel che si diffonde verso lo strato esterno, portando alla formazione di vuoti, crateri e a una perdita generale di integrità dello strato protettivo.
Questi risultati sono fondamentali per la progettazione e l’applicazione di superleghe in ambienti ad alto contenuto di zolfo, come quelli derivanti dall’uso di biocarburanti nelle turbine a gas. Capire questi meccanismi di degrado a lungo termine è essenziale per prevedere la vita utile dei componenti e per sviluppare leghe o rivestimenti protettivi più efficaci. Il nostro prossimo passo? Studiare come questo degrado interagisce con lo stress meccanico, un’altra condizione critica nelle turbine reali. Ma questa è un’altra storia!
Spero che questo tuffo nel mondo della corrosione ad alta temperatura vi sia piaciuto!
Fonte: Springer