Cellule Staminali Sotto Attacco: Cosa Fanno le Radiazioni e Come Possiamo Aiutarle?
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo delle cellule staminali, in particolare quelle che provengono dal cordone ombelicale umano, le cosiddette hucMSC (human umbilical cord mesenchymal stem cells). Queste cellule sono incredibilmente promettenti: hanno la capacità di trasformarsi in diversi tipi di cellule del nostro corpo e sono studiate per riparare tessuti danneggiati, anche quelli colpiti dalle radiazioni ionizzanti usate, ad esempio, nella radioterapia contro il cancro.
La radioterapia è un’arma potente contro i tumori, ma ahimè, può avere effetti collaterali sui tessuti sani circostanti. Pensate a danni al midollo osseo, al sistema immunitario, o persino alla sindrome acuta da radiazioni. Qui entrano in gioco le nostre hucMSC: l’idea è di usarle per aiutare il corpo a ripararsi dopo l’esposizione alle radiazioni. Ma c’è una domanda fondamentale a cui dovevamo rispondere: le radiazioni stesse danneggiano queste preziose cellule riparatrici? E se sì, come?
L’esperimento: cosa abbiamo fatto?
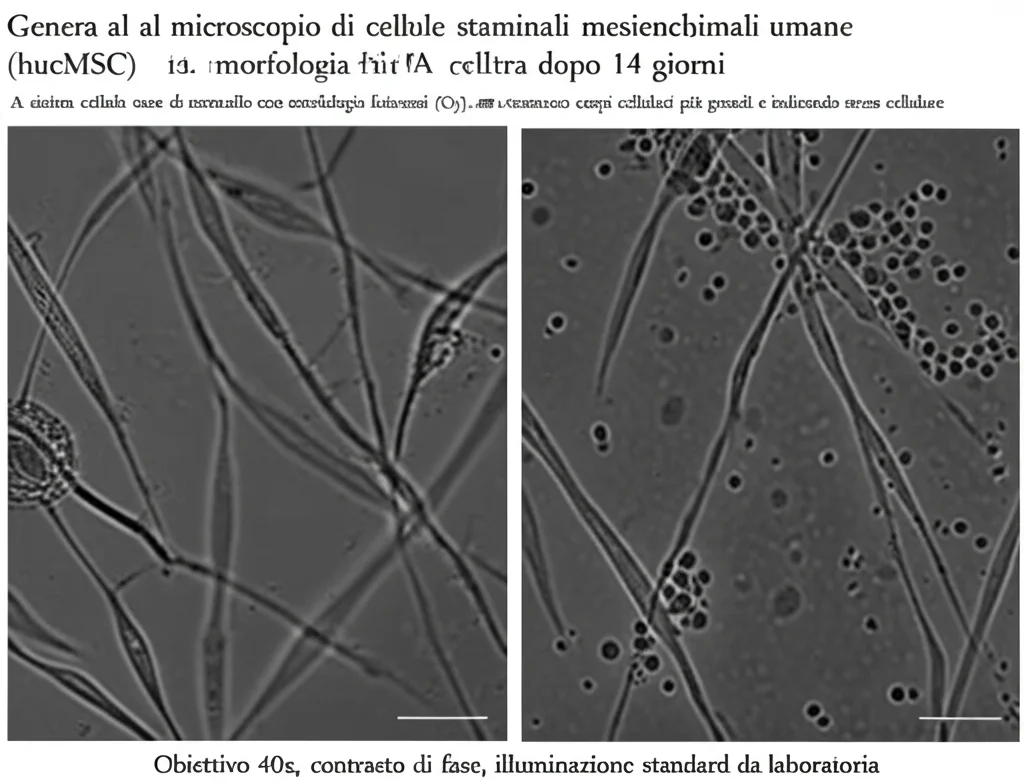
Per capirlo, abbiamo preso delle hucMSC in laboratorio e le abbiamo divise in due gruppi. Un gruppo è stato esposto a una dose di raggi X (1 Gray, o Gy – una dose considerata sufficiente a causare problemi ma non a distruggere completamente le cellule), mentre l’altro gruppo, il controllo, è stato lasciato tranquillo. Poi, per 14 giorni, abbiamo osservato cosa succedeva.
Abbiamo controllato come crescevano (proliferazione), quante morivano (apoptosi) e la loro capacità di “specializzarsi”, cioè di differenziarsi in cellule adipose (adipogenesi) e cellule ossee (osteogenesi). Ma non ci siamo fermati qui! Volevamo scavare più a fondo.
Uno sguardo più da vicino: Proteomica e Lipidomica
Per capire i meccanismi molecolari dietro i cambiamenti osservati, abbiamo usato due tecniche potentissime: la proteomica (lo studio di tutte le proteine in una cellula) e la lipidomica (lo studio di tutti i lipidi, cioè i grassi). È come avere una lente d’ingrandimento super potente per vedere cosa cambia a livello microscopico quando le cellule vengono irradiate.
Cosa succede alle cellule sotto i raggi X? Le brutte notizie…
I risultati sono stati chiari. Le radiazioni, anche a questa dose relativamente bassa, non fanno bene alle nostre hucMSC. Abbiamo osservato che:
- La crescita rallenta: Le cellule irradiate proliferavano molto meno rispetto a quelle del gruppo di controllo.
- Aumenta la morte cellulare: L’apoptosi era significativamente più alta nel gruppo irradiato.
- Diminuisce la capacità di specializzarsi: Sia la capacità di diventare cellule adipose (meno goccioline di grasso visibili) sia quella di diventare cellule ossee (meno noduli di calcio) erano ridotte dopo l’esposizione ai raggi X.
Insomma, le radiazioni sembrano proprio mettere i bastoni tra le ruote alle nostre hucMSC, limitando proprio quelle capacità che le rendono così interessanti per le terapie rigenerative.
Alla ricerca dei colpevoli: Lipidi e Proteine Chiave
Grazie alla lipidomica e alla proteomica, abbiamo identificato i “colpevoli” molecolari di questi cambiamenti.
Dal lato dei lipidi, abbiamo trovato differenze significative in molecole come i trigliceridi (TG) e la fosfatidilcolina (PC). Questi lipidi sono fondamentali per la struttura delle membrane cellulari e per l’accumulo di energia, e le loro alterazioni suggeriscono un profondo cambiamento nel metabolismo cellulare indotto dalle radiazioni. In particolare, abbiamo visto che le radiazioni influenzavano vie metaboliche importanti come quella dei glicerofosfolipidi e degli sfingolipidi.
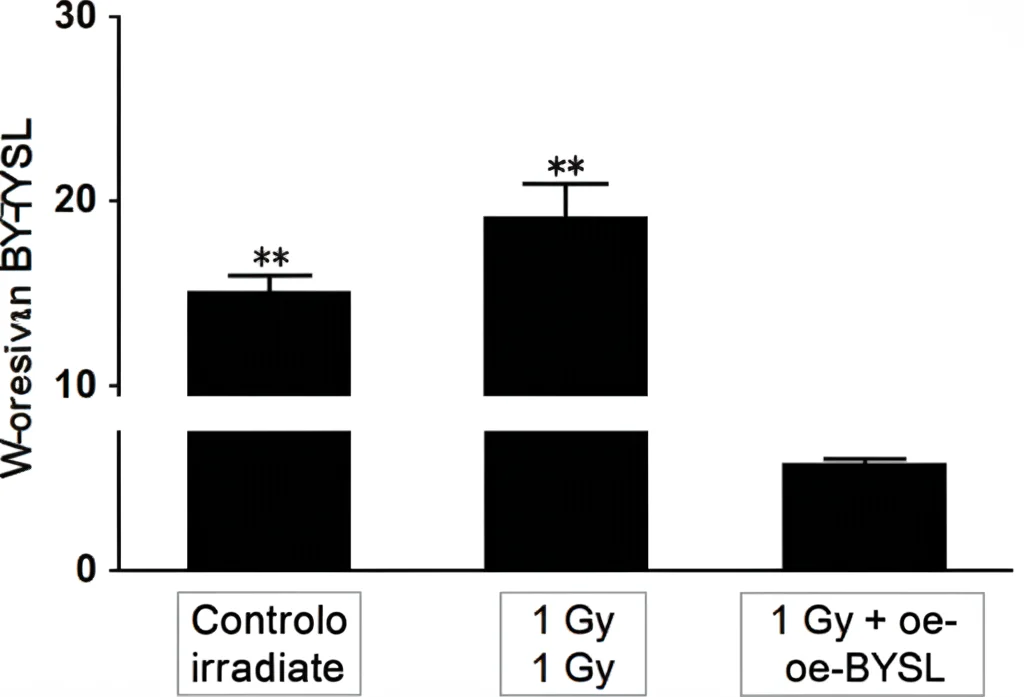
Dal lato delle proteine, abbiamo scovato ben 718 proteine che cambiavano “espressione” (cioè la loro quantità aumentava o diminuiva) dopo l’irradiazione. Tra queste, ne abbiamo individuate tre particolarmente importanti, dei veri e propri “hub” nella rete di interazioni proteiche, che risultavano significativamente meno presenti nelle cellule irradiate: BYSL, MRTO4 e RRP9. Queste proteine sono coinvolte in processi cruciali come la costruzione dei ribosomi (le fabbriche di proteine della cellula) e la regolazione del metabolismo cellulare.
E la cosa più interessante? Abbiamo scoperto che c’era una correlazione significativa tra i livelli di queste tre proteine hub (BYSL, MRTO4, RRP9) e i livelli dei lipidi chiave (TG e PC). Sembra proprio che proteine e lipidi lavorino insieme (o vengano disturbati insieme) in risposta alle radiazioni.
BYSL: Una proteina chiave e una possibile soluzione?
Tra le tre proteine hub, ci siamo concentrati su BYSL. Perché? Perché studi precedenti suggerivano un suo ruolo in percorsi di segnalazione cellulare importanti per la differenziazione, come il pathway GSK-3β/β-catenina. Ci siamo chiesti: e se aumentassimo artificialmente i livelli di BYSL nelle cellule irradiate? Potrebbe aiutarle a resistere meglio?
Abbiamo fatto proprio questo esperimento: abbiamo usato una tecnica di ingegneria genetica (vettori lentivirali) per “sovraesprimere” BYSL nelle hucMSC dopo che erano state irradiate. I risultati sono stati davvero incoraggianti!
- Più crescita, meno morte: Le cellule con più BYSL proliferavano meglio e andavano meno incontro ad apoptosi rispetto alle cellule irradiate normali.
- Migliore differenziazione: La capacità di trasformarsi sia in cellule adipose che ossee era significativamente migliorata!
Sembrava proprio che dare una “dose extra” di BYSL potesse contrastare molti degli effetti negativi delle radiazioni.
Come funziona BYSL? Il percorso GSK-3β/β-catenina
Ma come fa BYSL a fare tutto questo? Abbiamo indagato il meccanismo e confermato che la sovraespressione di BYSL attivava proprio il percorso di segnalazione GSK-3β/β-catenina. Abbiamo visto che i livelli delle proteine chiave di questo pathway (p-GSK-3β/GSK-3β e β-catenina) aumentavano nelle cellule con più BYSL.
Per essere ancora più sicuri, abbiamo usato un “inibitore”, una molecola (chiamata 1-Az) che blocca specificamente GSK-3β. Ebbene, quando abbiamo trattato le cellule irradiate e sovraesprimenti BYSL con questo inibitore, tutti gli effetti positivi di BYSL (migliore proliferazione, meno apoptosi, migliore differenziazione) venivano annullati! Questa è stata la prova del nove: BYSL aiuta le hucMSC irradiate agendo proprio attraverso la via GSK-3β/β-catenina.
Cosa significa tutto questo?
Questa ricerca ci dice cose importanti. Primo, conferma che le radiazioni ionizzanti, anche a dosi usate in terapia, possono compromettere le funzioni delle hucMSC, limitandone il potenziale rigenerativo. Secondo, identifica dei giocatori chiave in questa risposta: lipidi come TG e PC, e proteine come BYSL, MRTO4 e RRP9. Terzo, e forse più eccitante, suggerisce che manipolare i livelli di BYSL potrebbe essere una strategia per rendere le hucMSC più resistenti alle radiazioni e quindi più efficaci nelle terapie cellulari post-radioterapia.
Certo, siamo ancora all’inizio. Questi sono risultati ottenuti in laboratorio e serviranno ulteriori studi, anche in modelli animali e poi, si spera, nell’uomo, per confermare questi dati e capire come applicarli in clinica in modo sicuro ed efficace. Bisogna anche studiare meglio il ruolo di MRTO4 e RRP9. Ma è un passo avanti importante per capire come le nostre cellule reagiscono alle radiazioni e per trovare nuovi modi per sfruttare l’incredibile potenziale delle cellule staminali.
Fonte: Springer