TXNIP: Silenziare un Gene per Curare il Diabete? La Risposta (Inattesa) dalle Cellule Staminali
Ciao a tutti! Oggi voglio parlarvi di un viaggio affascinante nel mondo della biologia cellulare e dell’ingegneria genetica. Immaginate di avere un interruttore molecolare che regola processi chiave come lo stress cellulare e il metabolismo del glucosio. Questo interruttore esiste e si chiama TXNIP (Thioredoxin-interacting protein). Sappiamo che gioca un ruolo importante nel diabete, una malattia che colpisce centinaia di milioni di persone nel mondo, contribuendo alla disfunzione delle cellule del fegato (epatociti) e delle cellule beta del pancreas, quelle che producono insulina.
L’idea che ci ha guidato era intrigante: e se potessimo “spegnere” questo interruttore TXNIP nelle cellule staminali umane prima di trasformarle in cellule utili per combattere il diabete, come cellule del fegato o aggregati simili alle isole pancreatiche che producono insulina? La nostra ipotesi era che eliminando TXNIP, queste cellule potessero diventare più resistenti allo stress e funzionare meglio, aprendo magari nuove strade terapeutiche.
Un’idea intrigante: silenziare TXNIP con CRISPR
Per testare questa idea, abbiamo usato la potente tecnica di editing genetico CRISPR-Cas12a. Pensatela come delle forbici molecolari incredibilmente precise. Le abbiamo usate su cellule staminali embrionali umane (la linea H1, per i più tecnici) per tagliare via un pezzo fondamentale del gene TXNIP, creando così delle cellule staminali “knockout” (TXNIP-/-), cioè prive di una proteina TXNIP funzionante. Ovviamente, abbiamo mantenuto anche le cellule originali (TXNIP+/+) come controllo, per poter fare confronti.
Prima di tutto, dovevamo essere sicuri che le nostre modifiche non avessero “rotto” le cellule staminali. Abbiamo verificato che:
- La modifica genetica fosse avvenuta correttamente e solo nel punto desiderato (niente effetti collaterali “off-target” indesiderati).
- Le cellule modificate fossero ancora pluripotenti, cioè capaci di trasformarsi potenzialmente in qualsiasi tipo di cellula del corpo.
- Il loro “corredo” cromosomico (cariotipo) fosse rimasto intatto.
Tutto a posto! Le nostre cellule TXNIP-/- erano pronte per la fase successiva.
Cosa succede alle cellule staminali senza TXNIP?
Una delle prime cose che abbiamo notato è stata sorprendente: le cellule staminali senza TXNIP proliferavano di più, formavano colonie più grandi rispetto alle cellule normali. Questo ci ha ricordato il ruolo di TXNIP come una sorta di freno alla crescita in alcuni contesti, quasi un “soppressore tumorale”. Tuttavia, questa maggiore proliferazione non sembrava dovuta a una maggiore sopravvivenza o a una minore morte cellulare, ma proprio a una spinta intrinseca a dividersi di più.
Poi abbiamo messo alla prova la loro resistenza allo stress, in particolare allo stress del reticolo endoplasmatico (ER stress), un tipo di stress cellulare molto rilevante nel diabete. Abbiamo usato una sostanza chiamata tapsigargina per indurre questo stress. Analizzando migliaia di geni con una tecnica chiamata RNA-sequencing, abbiamo visto che, in generale, le cellule con e senza TXNIP rispondevano allo stress in modo molto simile. Attivavano le stesse vie di difesa. Una piccola differenza? Le cellule normali (TXNIP+/+) sembravano attivare un po’ di più le vie legate all’apoptosi (la morte cellulare programmata) sotto stress, forse suggerendo che l’assenza di TXNIP potesse conferire una leggerissima protezione in questo senso a livello di cellula staminale. Abbiamo anche notato che le cellule TXNIP-/- sotto stress attivavano un gene chiamato ERAS, legato alla proliferazione, il che potrebbe spiegare in parte la loro tendenza a crescere di più.
Insomma, a livello di cellula staminale, togliere TXNIP aumentava la proliferazione ma non sembrava migliorare drasticamente la risposta allo stress ER.
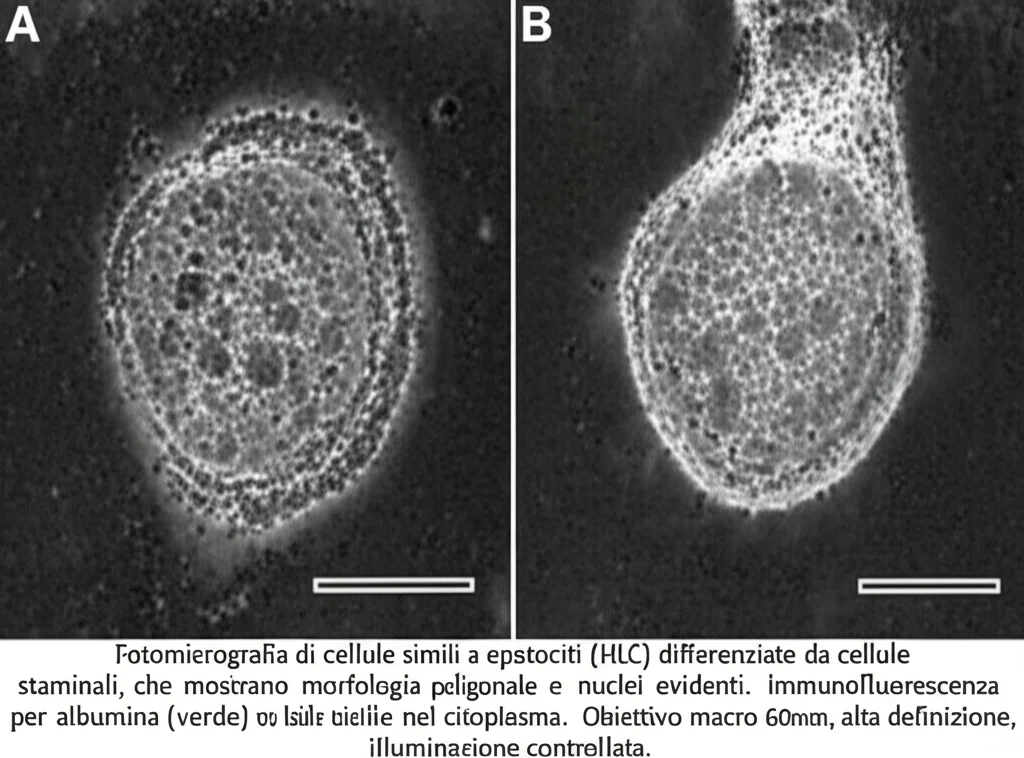
E le cellule del fegato (HLC)?
Il passo successivo era trasformare queste cellule staminali in qualcosa di più specifico: cellule simili agli epatociti (Hepatocyte-Like Cells, HLCs). Abbiamo seguito protocolli ben stabiliti e, sia le cellule TXNIP-/- che quelle TXNIP+/+, si sono differenziate con successo, mostrando i marcatori giusti nelle varie fasi.
Qui, però, sono emerse altre sorprese, non proprio quelle che speravamo. Le HLC senza TXNIP producevano e rilasciavano meno albumina (una proteina chiave prodotta dal fegato) rispetto alle HLC normali, specialmente nelle fasi finali della differenziazione. Questo suggerisce un potenziale problema nella funzione secretoria.
Abbiamo anche testato la loro risposta all’insulina. Risultato? Le HLC senza TXNIP mostravano una ridotta attivazione di AKT, una molecola fondamentale nella via di segnalazione dell’insulina. Questo non è un buon segno se pensiamo a migliorare la sensibilità all’insulina.
E la risposta allo stress ER nelle HLC? Anche qui, nessun vantaggio evidente. Anzi, le cellule TXNIP-/- mostravano livelli più bassi di una proteina chaperon cruciale (BiP) dopo stress prolungato e una attivazione iniziale alterata di un’altra via di segnalazione dello stress (PERK/eIF2α). Sembrava quasi che la loro capacità di adattarsi allo stress fosse compromessa, non migliorata. Abbiamo anche controllato il metabolismo del glucosio (glicolisi) in tempo reale con un biosensore fluorescente (HYlight), ma non abbiamo trovato differenze significative tra i due tipi di HLC.
Quindi, per le cellule del fegato, l’assenza di TXNIP non solo non portava benefici, ma sembrava addirittura peggiorare alcuni aspetti funzionali.
Passiamo alle isole pancreatiche ‘fatte in casa’ (SC-islets)
L’altro obiettivo erano le cellule produttrici di insulina. Abbiamo differenziato le nostre cellule staminali (sia TXNIP-/- che TXNIP+/+) in aggregati tridimensionali che assomigliano alle isole pancreatiche (Stem Cell-derived Islets, SC-islets). Anche in questo caso, la differenziazione è andata a buon fine per entrambi i tipi di cellule. Gli aggregati contenevano la giusta miscela di cellule che producono insulina (la maggioranza), glucagone e somatostatina, senza differenze significative tra TXNIP-/- e TXNIP+/+. Anche la vitalità cellulare era comparabile.
Un aspetto interessante nel diabete è l’infiammazione. Le citochine infiammatorie, come l’interferone alfa (IFNα) e gamma (IFNγ), possono danneggiare le cellule beta. Abbiamo esposto le nostre SC-islets a queste citochine per vedere come rispondevano, misurando l’attivazione di una molecola segnale chiamata STAT1. Qui abbiamo notato una differenza: nelle SC-islets senza TXNIP, l’attivazione di STAT1 in risposta alle citochine era attenuata, più lenta e meno intensa all’inizio rispetto alle cellule normali. Questo suggerisce che TXNIP potrebbe giocare un ruolo nel modulare la risposta infiammatoria nelle cellule beta, ma le implicazioni funzionali di questa osservazione non erano immediatamente chiare.
La prova del nove: il trapianto nei topi
Il test definitivo per le SC-islets è vedere come si comportano in vivo. Abbiamo trapiantato gli aggregati (sia TXNIP-/- che TXNIP+/+) sotto la capsula renale di topi immunodeficienti (NOD-SCID), un modello standard per questi studi. Abbiamo seguito i topi per 16 settimane, monitorando i livelli di glucosio nel sangue e la produzione di C-peptide umano (un indicatore della produzione di insulina umana dalle cellule trapiantate).
Cosa abbiamo scoperto? Entrambi i tipi di trapianto hanno funzionato! Le SC-islets sono maturate, hanno iniziato a produrre insulina e hanno portato i livelli di glucosio dei topi a livelli fisiologici umani (più bassi di quelli normali dei topi). Questo è un segno di successo del trapianto e della maturazione delle cellule.
Ma la domanda cruciale era: le SC-islets senza TXNIP funzionavano meglio? La risposta è stata no. Non abbiamo visto alcuna differenza significativa tra i topi trapiantati con cellule TXNIP-/- e quelli con cellule TXNIP+/+ in termini di:
- Controllo della glicemia a digiuno.
- Livelli di C-peptide umano.
- Capacità di gestire un carico di glucosio (test di tolleranza al glucosio, GTT).
- Capacità di secernere insulina in risposta al glucosio (test di secrezione di insulina stimolata dal glucosio, GSIS).
Abbiamo anche indotto il diabete nei topi distruggendo le loro cellule beta native con streptozotocina (STZ). I trapianti (sia TXNIP-/- che TXNIP+/+) sono stati in grado di mantenere il controllo glicemico, dimostrando la loro funzionalità. Rimuovendo il rene con il trapianto, i topi diventavano iperglicemici, confermando che erano proprio le cellule umane trapiantate a controllare il glucosio. Ma, ancora una volta, nessuna superiorità delle cellule TXNIP-/-.
Cosa ci portiamo a casa?
Il nostro viaggio ci ha portato a una conclusione chiara, anche se diversa dalle nostre aspettative iniziali: eliminare TXNIP nelle cellule staminali embrionali umane H1 non migliora la differenziazione o la funzionalità delle cellule epatiche (HLC) o delle isole pancreatiche (SC-islets) derivate, almeno nelle condizioni che abbiamo testato. Anzi, per le HLC abbiamo visto persino effetti potenzialmente negativi sulla secrezione e sulla segnalazione insulinica. Per le SC-islets, nonostante una modulazione della risposta infiammatoria in vitro, non abbiamo osservato alcun beneficio funzionale in vivo.
Questo non significa che lo studio sia stato inutile, anzi! Abbiamo generato e caratterizzato per la prima volta linee cellulari umane TXNIP knockout partendo da cellule staminali embrionali, differenziandole in due tipi cellulari metabolici cruciali. Queste linee cellulari (sia le TXNIP-/- che le loro controparti TXNIP+/+) sono ora strumenti preziosi per la comunità scientifica. Possono essere usate per:
- Studiare più a fondo i meccanismi con cui TXNIP regola lo stress ossidativo, lo stress ER, l’infiammazione e il metabolismo.
- Esplorare interazioni con altri geni importanti per il metabolismo.
- Testare nuovi farmaci che mirano a TXNIP, usando queste cellule come sistema di controllo.
- Investigare meccanismi epigenetici, come la metilazione del promotore di TXNIP, legati alla “memoria metabolica”.
Certo, il nostro studio ha delle limitazioni, come l’uso di una sola linea di cellule staminali e di un modello animale immunodeficiente. Future ricerche potrebbero esplorare altri background genetici o usare modelli animali più complessi.
Ma per ora, la storia che queste cellule ci raccontano è che la biologia è complessa e non sempre lineare. A volte, spegnere un interruttore che sembra problematico non porta necessariamente alla soluzione desiderata, ma ci fornisce comunque conoscenze fondamentali e nuovi strumenti per continuare la ricerca.
Fonte: Springer