Il Segreto del Rame: Come l’Enzima DPOR Svela la Danza Asimmetrica degli Elettroni
Ciao a tutti, appassionati di scienza e misteri della natura! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico delle molecole, dove scopriremo insieme come un enzima un po’ speciale, chiamato DPOR, orchestra una danza incredibilmente precisa per fare qualcosa di fondamentale: aiutare a costruire la clorofilla, la molecola che permette alle piante di catturare la luce del sole. E lo fa… al buio! Sembra un controsenso, vero? Ma la biologia è piena di sorprese.
Un Enzima Misterioso che Lavora al Buio
Immaginate la clorofilla, quel pigmento verde che è sinonimo di vita vegetale. La sua produzione è un processo complesso, e uno dei passaggi chiave è la trasformazione di una molecola chiamata protoclorofillide (Pchlide) in clorofillide (Chlide). Molti organismi, come le piante che vediamo tutti i giorni (le angiosperme), usano un enzima che ha bisogno di luce per fare questo lavoro (LPOR). Ma altri, come batteri fotosintetici, alghe e gimnosperme, hanno un’alternativa che funziona anche al buio: il nostro protagonista, DPOR (Dark-Operative Protochlorophyllide Oxidoreductase).
Questo DPOR è un tipo interessante. Assomiglia strutturalmente a un altro enzima famosissimo, la nitrogenasi, quella che trasforma l’azoto atmosferico in ammoniaca, essenziale per la vita. Entrambi sono come dei “trasformatori molecolari” composti da due parti principali che devono collaborare:
- Una parte “donatrice” di elettroni (chiamata proteina L nel DPOR, o BchL).
- Una parte “accettrice” di elettroni (chiamata proteina NB nel DPOR, o BchN-BchB).
Queste due parti si uniscono temporaneamente, grazie all’energia fornita dall’ATP (la “benzina” delle cellule), per far passare gli elettroni dalla proteina L alla proteina NB, dove si trova il Pchlide da trasformare. Per trasformare una molecola di Pchlide servono due elettroni, quindi questo “passaggio di mano” deve avvenire due volte.
La proteina NB è particolarmente intrigante: è un tetramero, formato da quattro pezzi (due subunità BchN e due BchB), e ha una struttura che sembra perfettamente simmetrica, come due metà identiche speculari. Per anni, abbiamo pensato che queste due metà lavorassero in modo indipendente. Ma la natura, si sa, ama complicare le cose in modi eleganti.
Occhi Puntati sulla Struttura: Arriva la Crio-EM
Capire come funzionano queste macchine molecolari complesse non è facile. Sono piccolissime e si muovono velocemente. Qui entra in gioco una tecnologia pazzesca: la crio-microscopia elettronica (Crio-EM). Immaginate di poter congelare istantaneamente queste molecole nel bel mezzo della loro attività e poi di “fotografarle” con un dettaglio incredibile usando un fascio di elettroni. Combinando migliaia di queste “foto”, possiamo ricostruire la struttura tridimensionale dell’enzima mentre lavora.
Ed è proprio quello che abbiamo fatto! Abbiamo usato la Crio-EM per “spiare” il DPOR di un batterio chiamato Rhodobacter sphaeroides in diversi momenti cruciali:
- Da solo (stato apo).
- Legato al suo substrato, il Pchlide.
- Durante la reazione vera e propria (turnover), con ATP presente.
- In uno stato “bloccato” a metà reazione (stato di transizione), usando un analogo dell’ATP (ADP-AlF3).
Quello che abbiamo visto ci ha lasciato a bocca aperta.
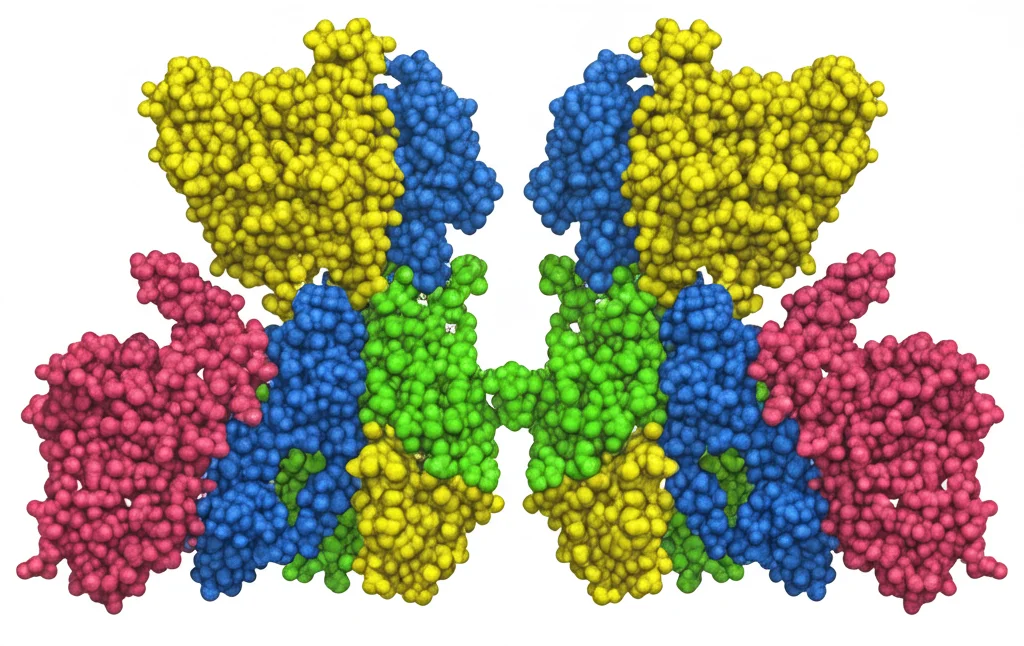
La Sorpresa: Non Siamo Simmetrici!
La prima grande scoperta è stata che, nonostante la struttura apparentemente simmetrica della proteina NB, la sua funzione non lo è affatto! Quando il Pchlide si lega, succede qualcosa di strano: le due metà iniziano a comportarsi in modo diverso. È come se una metà dicesse all’altra: “Aspetta un attimo, inizio io!”. Questa asimmetria funzionale sembra essere intrinseca alla proteina NB e viene accentuata dal legame con il substrato.
Abbiamo notato che una metà della proteina NB sembrava più “dinamica” o “flessibile” dell’altra, suggerendo che i cambiamenti conformazionali non avvengono in modo uguale su entrambi i lati. Questa asimmetria ha conseguenze importanti: influenza il modo in cui la proteina L (il donatore di elettroni) si lega alla proteina NB.
Il Rame Entra in Scena: Un Centro di Controllo Inaspettato
Ma la scoperta forse più eccitante è stata trovare qualcosa di completamente nuovo proprio al centro della proteina NB, all’interfaccia tra le sue due metà: un sito di-rame (di-Cu). Proprio così, due atomi di rame tenuti insieme da amminoacidi specifici (Istidina 404 e Metionina 408) provenienti da entrambe le metà della proteina.
Questo sito di-rame non era mai stato visto prima nelle strutture cristallografiche precedenti (forse a causa delle condizioni di cristallizzazione che lo avevano rimosso?). Ma nelle nostre immagini Crio-EM era lì, inequivocabile. E non è solo un dettaglio strutturale: è fondamentale per l’attività dell’enzima. Abbiamo creato una versione mutante del DPOR in cui questi amminoacidi che legano il rame erano stati sostituiti: risultato? L’enzima era completamente inattivo!
Questo ci ha fatto capire che il sito di-rame non è lì per caso. Sembra agire come un centro di comunicazione, un hub che trasmette segnali allosterici (cioè segnali a distanza) tra le due metà della proteina NB. È come il direttore d’orchestra che coordina i musicisti!
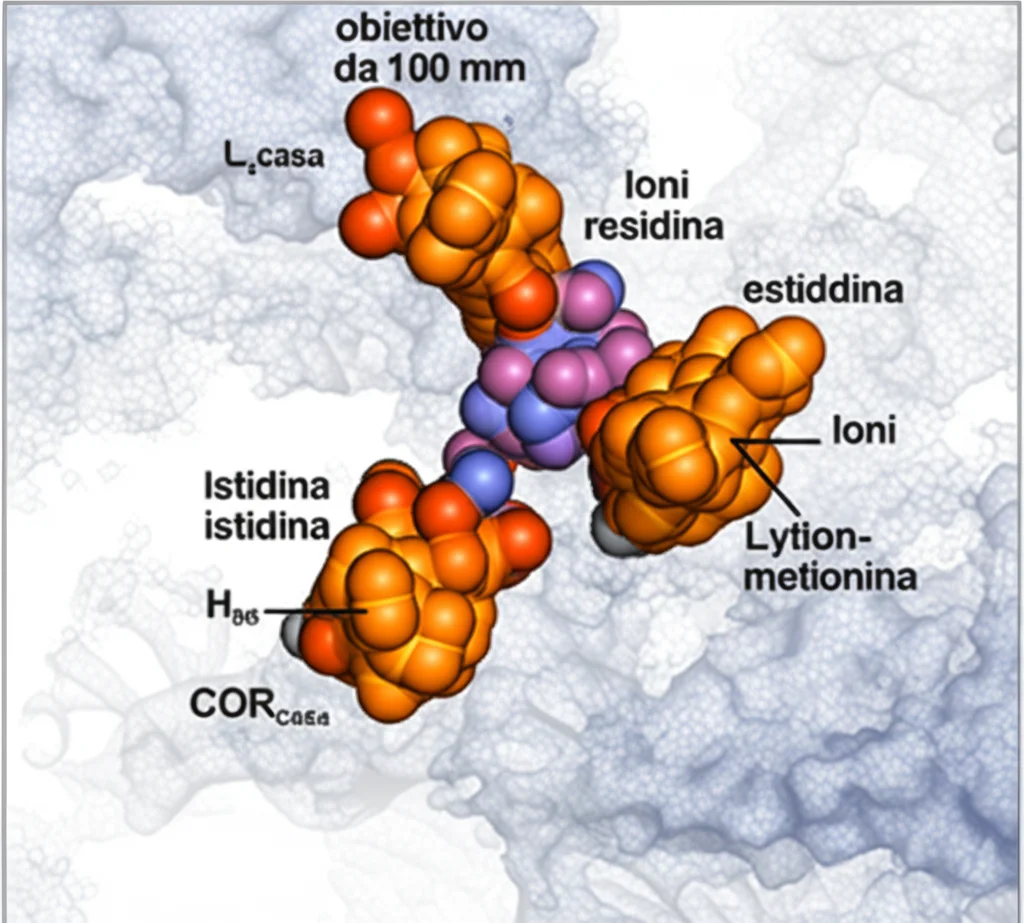
La Danza Coordinata degli Elettroni
Mettendo insieme tutti i pezzi, emerge un quadro affascinante di come funziona il DPOR:
1. Legame del Substrato e Asimmetria: Il Pchlide si lega a entrambi i siti attivi della proteina NB, ma questo legame accentua un’asimmetria intrinseca. Le due metà non sono più funzionalmente uguali. Addirittura, sembra che anche le molecole di Pchlide legate nei due siti non abbiano esattamente la stessa conformazione, forse si “piegano” o si “increspano” in modo diverso. Questo potrebbe essere un modo per l’enzima di “sentire” se ha legato il substrato (Pchlide) o il prodotto (Chlide), che differiscono solo per un doppio legame!
2. Comunicazione via Rame: L’informazione sullo stato di una metà (es. “ho legato il substrato”) viene trasmessa all’altra metà attraverso cambiamenti strutturali che passano per il sito di-rame. Lunghe eliche proteiche, che contengono gli amminoacidi che legano il rame, sembrano giocare un ruolo chiave in questa comunicazione, interagendo addirittura *in trans* (cioè l’elica di una metà interagisce con il Pchlide legato nell’altra metà).
3. Legame Asimmetrico del Donatore: L’asimmetria indotta nella proteina NB fa sì che la proteina L (il donatore di elettroni) si leghi preferenzialmente a *una sola* delle due metà alla volta, almeno durante la normale reazione con ATP. Questo lo abbiamo visto chiaramente nelle nostre strutture Crio-EM “in azione”: trovavamo complessi con una proteina NB e *una* proteina L, non due come ci si poteva aspettare dalla simmetria strutturale o come visto in studi precedenti bloccati con analoghi dell’ATP.
4. Trasferimento Elettronico Controllato: In una metà, gli amminoacidi che formano il “canale” per il passaggio degli elettroni dal cluster ferro-zolfo [4Fe-4S]NB al Pchlide sono allineati correttamente, permettendo il trasferimento. Nell’altra metà, questi stessi residui adottano conformazioni diverse, bloccando di fatto il trasferimento e probabilmente anche il legame della proteina L. L’asimmetria serve quindi a garantire che gli elettroni vengano consegnati nel posto giusto al momento giusto, uno alla volta per metà.
5. Interruttore a ATP e Rilascio: Una volta che il primo elettrone (o forse entrambi necessari per una metà) è stato trasferito, l’idrolisi dell’ATP da parte della proteina L innesca un cambiamento conformazionale. Questo cambiamento viene comunicato all’altra metà, sempre attraverso il sito di-rame, attivandola per il ciclo successivo di legame della proteina L e trasferimento elettronico.
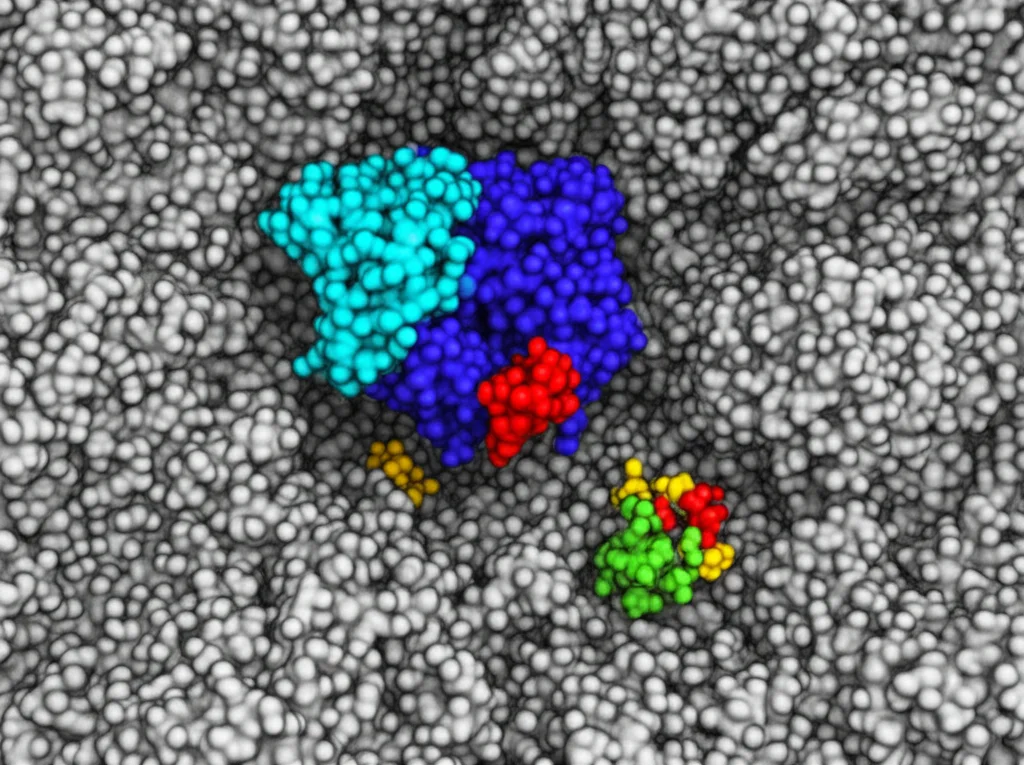
Il Partner che Balla Fuori Sincrono: La Proteina L
Un altro aspetto interessante riguarda proprio la proteina L. Nelle nostre strutture Crio-EM, la proteina L si lega alla proteina NB in una posizione diversa, ruotata di circa 45-50 gradi, rispetto a quanto visto in strutture cristallografiche precedenti. In questa posizione “laterale”, i cluster ferro-zolfo delle due proteine sono troppo distanti (~39 Å) per un trasferimento elettronico efficiente (che richiede una distanza di ~14 Å).
Cosa significa? Probabilmente la proteina L adotta almeno due posizioni: una “sopra” la proteina NB, ottimale per il trasferimento elettronico (ma forse molto transiente e difficile da catturare), e una “di lato”, che è quella che abbiamo visto noi, forse uno stato post-trasferimento o pre-distacco. Questo movimento, una sorta di “rotolamento”, potrebbe essere legato all’idrolisi dell’ATP e regolato da una regione flessibile all’inizio della proteina L (N-terminale) che normalmente ha una funzione auto-inibitoria. L’ATP aiuterebbe a “spostare” questa regione, permettendo il legame e il trasferimento.
Oltre il DPOR: Un Principio Universale?
Questa scoperta dell’asimmetria funzionale coordinata da un sito metallico centrale nel DPOR è davvero emozionante. Ci fornisce un modello dettagliato di come enzimi complessi possano regolare reazioni che avvengono su lunghe distanze, come il trasferimento di elettroni.
E la cosa più bella è che questo principio potrebbe non essere limitato al DPOR. Anche nella nitrogenasi, studi recenti di Crio-EM hanno mostrato un legame asimmetrico del suo partner donatore di elettroni durante la reazione. E meccanismi simili di asimmetria funzionale sono stati osservati in altri importanti enzimi che trasferiscono elettroni a distanza, come la ribonucleotide reduttasi (RNR) e la nitrossido sintasi (NOS).
Sembra quindi che la natura abbia escogitato questa strategia dell’asimmetria come un modo comune ed efficace per controllare processi biochimici complessi e delicati. Il nostro studio sul DPOR, reso possibile dalla potenza della Crio-EM, aggiunge un tassello fondamentale a questo puzzle, rivelando il ruolo inaspettato ma cruciale del sito di-rame come centro di controllo allosterico.
Certo, rimangono ancora tante domande aperte: come esattamente il rame partecipa alla comunicazione? Come viene attivata la seconda metà? Come è coordinato il tutto con l’uso dell’ATP? Ma è proprio questo il bello della scienza: ogni risposta apre la porta a nuove, affascinanti domande!
Spero che questo viaggio nel cuore del DPOR vi sia piaciuto. È incredibile pensare a quanta complessità ed eleganza si nascondano nel funzionamento delle molecole che rendono possibile la vita come la conosciamo.
Fonte: Springer







