Elettrocatalisi CO2: Stabilità Record Grazie al Doppio Strato Metallo-Organico!
Ciao a tutti, appassionati di scienza e futuro sostenibile! Oggi voglio parlarvi di una scoperta che mi ha davvero elettrizzato, un passo avanti potenzialmente enorme nel campo della riduzione elettrochimica della CO2 (quella che gli scienziati chiamano eCO2R). Immaginate di poter prendere l’anidride carbonica, quel gas serra di cui tanto si parla, e trasformarla, usando elettricità da fonti rinnovabili, in sostanze chimiche utili, come l’etilene, una delle basi della plastica. Sembra fantascienza? Beh, ci stiamo avvicinando, ma c’è un “ma”.
La Sfida: Elettrodi Stabili per l’Industria
Per fare questa magia su scala industriale, servono degli strumenti speciali chiamati elettrodi a diffusione gassosa (GDE). Pensateli come delle spugne super tecnologiche che permettono al gas (CO2), al liquido (l’elettrolita) e al solido (il catalizzatore, spesso a base di rame per ottenere prodotti più complessi come l’etilene) di incontrarsi e reagire nel modo giusto. Il problema è che questi GDE sono un po’ delicati. Soffrono di:
- Corrosione
- “Allagamento” (flooding), quando l’acqua invade troppo i pori
- Delaminazione (il catalizzatore si stacca)
- Precipitazione di sali (carbonati/bicarbonati che si formano e intasano tutto)
Quest’ultimo punto è particolarmente fastidioso. Anche in ambienti non basici, si formano idrossidi che reagiscono con la CO2 creando questi sali. I sali bloccano il passaggio della CO2, la reazione principale rallenta e iniziano reazioni indesiderate, come la produzione di idrogeno. Un bel pasticcio che limita la durata e l’efficienza del processo.
L’Idea Geniale: Un “Cappotto” Metallo-Organico
Qui entra in gioco l’idea brillante dei ricercatori di cui vi parlo oggi. Hanno pensato: “E se proteggessimo l’elettrodo di rame con una sorta di scudo molecolare?”. Detto, fatto! Hanno usato una tecnica chiamata elettrofilatura (electrospinning) per depositare un sottilissimo film di un polimero speciale, un alcool polivinilico modificato (chiamato PVAQA), sopra l’elettrodo di rame.
Ma non è un cappotto qualsiasi. Questo strato crea quello che hanno battezzato Doppio Strato Metallo-Organico (MODL). È una rivisitazione furba del classico “doppio strato elettrico” che si forma all’interfaccia tra un elettrodo e un elettrolita. Nel modello classico, ci sono ioni idratati che si dispongono vicino all’elettrodo. Nel MODL, invece, questi ioni sono sostituiti dai gruppi funzionali del polimero, in particolare gruppi cationici (ammonio quaternario, QA) e gruppi ossidrilici (-OH), legati tra loro da legami idrogeno.
Questo design è stato pensato con cura:
- Il polimero (PVA) si “gela” a contatto con l’acqua, creando un’interfaccia idratata intima con una struttura dell’acqua ben definita.
- Il film elettrofilato è meccanicamente robusto e impedisce al catalizzatore di staccarsi.
- I gruppi QA positivi regolano il passaggio degli ioni (come vedremo, bloccano quelli “scomodi”) e modulano il campo elettrico locale.
- I gruppi ossidrilici mantengono una rete di legami idrogeno fondamentale per stabilizzare le molecole intermedie della reazione.

Risultati da Urlo: Efficienza e Stabilità Mai Viste!
E i risultati? Preparatevi: l’elettrodo così modificato (in particolare la versione PTFE/Cu/PVAQA54) ha mostrato un’efficienza Faradaica (FE) pazzesca del 91.2 ± 3.8% verso prodotti multi-carbonio (C2+) a una densità di corrente industriale (300 mA cm⁻²). Non solo: ha mantenuto questa performance per oltre 300 ore di funzionamento continuo in una cella a flusso alcalina! Un record di stabilità notevole.
Non contenti, lo hanno testato anche in una configurazione diversa, chiamata MEA (Membrane Electrode Assembly), usando acqua pura come anolita (la parte “positiva” della cella). Anche qui, ottimi risultati: un’efficienza verso l’etilene (C2H4) superiore al 50% a 200 mA cm⁻², stabile per oltre 20 ore. Questi numeri sono tra i migliori mai riportati e soddisfano i requisiti tecno-economici per un’applicazione industriale.
Ma Come Funziona Esattamente Questo MODL?
Ok, i risultati sono impressionanti, ma qual è il segreto dietro questo successo? Qui la scienza si fa affascinante. I ricercatori hanno usato tecniche spettroscopiche avanzate (*in situ* FT-IR e Raman) e simulazioni di dinamica molecolare (*ab initio*, AIMD) per guardare da vicino cosa succede all’interfaccia.
Hanno scoperto un gioco di squadra tra i gruppi QA e i gruppi ossidrilici del polimero.
Il Ruolo dei Gruppi QA (Ammonio Quaternario):
Questi gruppi carichi positivamente fanno due cose fondamentali:
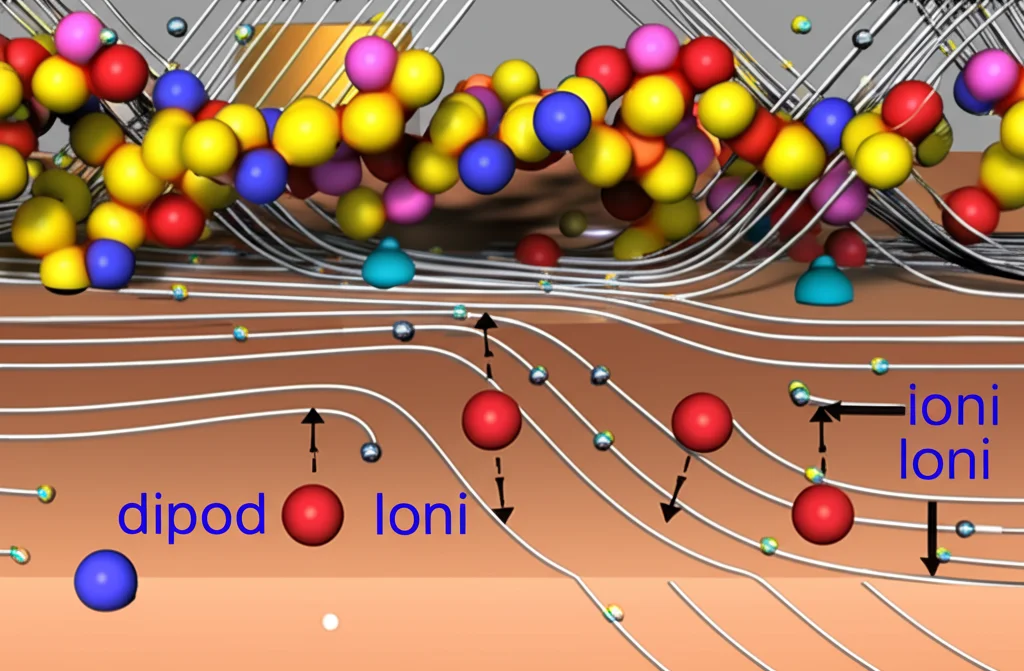
1. Bloccano gli ioni potassio (K+): Nelle celle alcaline, gli ioni K+ contribuiscono alla formazione dei sali che intasano l’elettrodo. Il film di PVAQA agisce come una barriera selettiva (effetto Donnan), respingendo i cationi K+ e impedendo loro di raggiungere l’interno del GDE. Le simulazioni hanno confermato che il K+ viene letteralmente “spinto via” dalla regione del MODL. Addio intasamento da sali!
2. Modulano il campo elettrico e la struttura dell’acqua: La carica positiva dei QA intensifica il campo elettrico locale vicino alla superficie del rame. Questo “polarizza” le molecole d’acqua vicine, rendendole più ordinate (con gli idrogeni rivolti verso il basso) e più propense a dissociarsi (H2O -> H+ + OH-). Inoltre, intrappolano gli anioni OH-, aumentando il pH locale. Un pH più alto favorisce la reazione chiave che lega due atomi di carbonio (C-C coupling) per formare prodotti C2+. Le analisi *in situ* hanno mostrato proprio questo: più acqua polarizzata e un pH locale più alto con il PVAQA rispetto a polimeri senza QA.
Il Ruolo dei Gruppi Ossidrilici (-OH):
Questi gruppi sono maestri nel creare una fitta rete di legami idrogeno all’interfaccia. Questa rete fa diverse cose utili:
1. Stabilizza gli intermedi di reazione: In particolare, sembra stabilizzare l’intermedio *CO (monossido di carbonio adsorbito sulla superficie del rame), che è cruciale per il C-C coupling. Lo fa formando legami idrogeno diretti (O-H···O≡C) o indiretti tramite molecole d’acqua.
2. Migliora la connettività dell’acqua: A differenza di altri polimeri (come il PEO, privo di -OH), il PVA mantiene una rete di legami idrogeno continua e ben organizzata all’interno del MODL, facilitando i processi che richiedono la partecipazione dell’acqua.
3. Abbassa le barriere energetiche: Le simulazioni AIMD hanno mostrato che l’interfaccia creata dal PVAQA, grazie alla sinergia tra QA e -OH, abbassa significativamente l’energia necessaria per la reazione di C-C coupling (*CO + *CO -> *OCCO) rispetto a un’interfaccia con un polimero simile ma senza QA (PVAPA).
Sinergia e Prospettive Future
La chiave è proprio la sinergia: i gruppi QA gestiscono il campo elettrico, la polarizzazione dell’acqua e il blocco degli ioni, mentre i gruppi -OH tessono la rete di legami idrogeno che stabilizza gli intermedi e facilita la reazione. Insieme, creano un microambiente ideale sulla superficie del catalizzatore di rame per produrre selettivamente etilene e altri prodotti C2+ con una stabilità eccezionale.
Il fatto che funzioni bene anche in MEA con acqua pura è molto promettente, perché elimina la necessità di elettroliti liquidi circolanti, semplificando il sistema. Anche se la durata in MEA è ancora limitata dalla membrana commerciale usata, l’elettrodo stesso si è dimostrato robusto.
Cosa significa tutto questo? Che abbiamo una nuova strategia potente e versatile per migliorare l’elettrocatalisi della CO2. Il metodo di fabbricazione (deposizione fisica e elettrofilatura) è scalabile. Il concetto di MODL apre la porta a progettare interfacce su misura, magari usando altri gruppi funzionali (ammine, carbossilati, ecc.) per ottimizzare la produzione di specifici composti chimici a partire dalla CO2.
Siamo ancora all’inizio, ma studi come questo ci mostrano una via concreta per trasformare un problema (la CO2 in eccesso) in una soluzione (prodotti chimici sostenibili), sfruttando la potenza dell’elettrochimica e dell’ingegneria molecolare. Non è affascinante? Io credo proprio di sì!
Fonte: Springer