Dolore Cronico e Depressione: Ho Trovato il Filo Rosso che Li Lega nel Cervello!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona profondamente e che tocca la vita di tantissime persone: il legame, spesso oscuro e debilitante, tra il dolore cronico e la depressione. È un problema enorme, sapete? Chi soffre di dolore persistente ha una probabilità molto più alta di sviluppare sintomi depressivi, e viceversa. Queste due condizioni, quando si presentano insieme (quella che noi chiamiamo comorbilità), rendono la vita un vero incubo e le terapie spesso faticano a funzionare. Ma perché? Cosa succede nel nostro cervello?
Ecco, questa è stata la domanda che mi (e al mio team di ricerca, ovviamente!) ha spinto a indagare. Sentivamo che doveva esserci una spiegazione a livello neurale, un circuito specifico che facesse da ponte tra la sensazione fisica del dolore e lo stato emotivo della depressione.
I Sospettati Principali: S1 e Amigdala
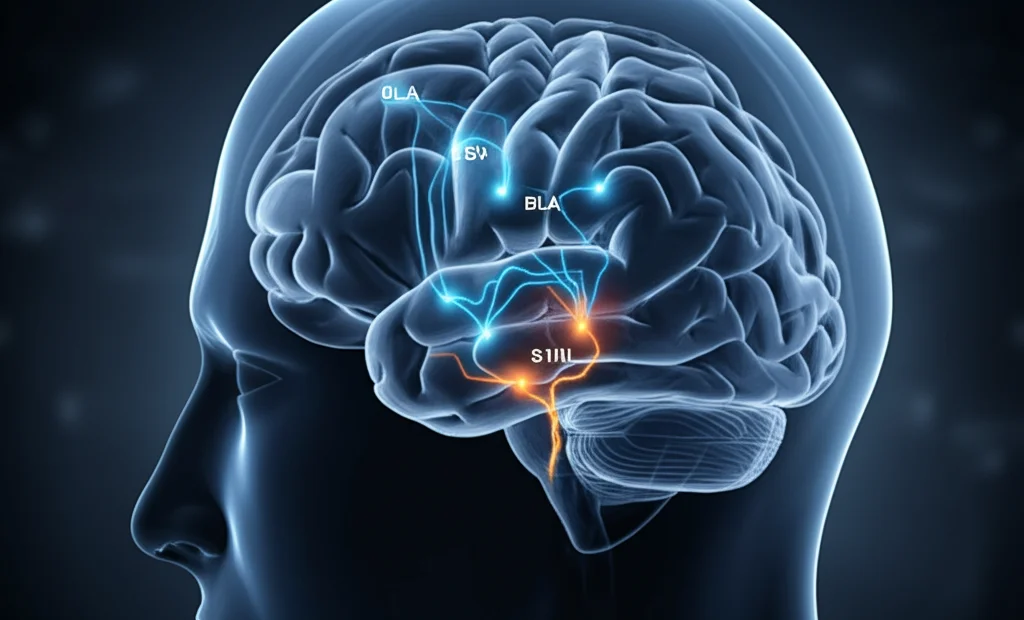
Abbiamo iniziato a puntare i riflettori su due aree cerebrali chiave. La prima è la corteccia somatosensoriale primaria (S1), in particolare la zona che processa le informazioni provenienti dagli arti inferiori (chiamata S1HL). Questa è un po’ la centrale di smistamento delle sensazioni tattili e dolorose. Sappiamo che nel dolore cronico, l’S1 va spesso in “tilt”, diventando iperattiva.
Il secondo sospettato è l’amigdala, e più precisamente il nucleo basolaterale (BLA). L’amigdala è famosa per essere il centro di controllo delle emozioni, una sorta di “porta sensoriale verso le emozioni”. È lei che riceve informazioni sensoriali e le trasforma in stati affettivi, come paura, ansia… e depressione. Alterazioni nell’amigdala sono state osservate spesso in persone depresse.
Poteva essere che un’autostrada diretta collegasse queste due aree, e che questa connessione avesse un ruolo nella transizione dal dolore alla depressione?
L’Indagine: Mappe Neurali e Interruttori Molecolari
Per scoprirlo, ci siamo messi all’opera usando modelli animali (topolini, in questo caso) in cui abbiamo indotto una condizione di dolore neuropatico cronico, chiamata Spared Nerve Injury (SNI). È un modello molto usato che mima il dolore persistente che alcune persone sperimentano dopo una lesione nervosa.
Abbiamo seguito questi topolini nel tempo, osservando non solo la loro sensibilità al dolore (con test specifici come il test di Von Frey), ma anche i loro comportamenti legati all’umore, usando test come:
- Il Sucrose Preference Test (SPT): misura quanto i topolini preferiscono bere acqua zuccherata rispetto all’acqua normale. Una minore preferenza per lo zucchero è un segno di anedonia, un sintomo chiave della depressione.
- Il Forced Swim Test (FST): misura il tempo in cui un topolino rimane immobile quando messo in acqua. Un tempo di immobilità maggiore è interpretato come un segno di “rassegnazione” o comportamento depressivo.
Contemporaneamente, abbiamo “fotografato” l’attività dei neuroni in S1HL e BLA in diversi momenti dopo l’induzione del dolore, usando un marcatore chiamato c-Fos, che si illumina nelle cellule attive.

La Sorprendente Scoperta: Un Circuito Dedicato Dolore-Depressione
E qui le cose si sono fatte davvero interessanti!
1. Dolore Cronico -> Comportamenti Depressivi: Abbiamo confermato che i topolini con dolore cronico (dopo circa 28 giorni dalla lesione SNI) sviluppavano effettivamente comportamenti simili alla depressione: mostravano meno interesse per l’acqua zuccherata ed erano più immobili nel test di nuoto forzato, rispetto ai topolini senza dolore o con dolore da meno tempo.
2. Attività Sincronizzata: Proprio in questa fase “cronica” (a 28 giorni), abbiamo visto un’esplosione dell’attività neuronale (un sacco di c-Fos!) sia nella S1HL che nella BLA controlaterali alla lesione. Nelle fasi più precoci del dolore (2 o 7 giorni), l’S1HL era già attiva (correlata al dolore), ma la BLA si “accendeva” significativamente solo quando comparivano i sintomi depressivi. Questo suggeriva un’iperattività concomitante delle due aree proprio nello stato di comorbilità.
3. Mappatura del Circuito S1HL → BLA: Usando tecniche di tracciamento virale (un po’ come mettere dei GPS nei neuroni!), abbiamo identificato un percorso diretto che va dalla S1HL alla BLA. E non un percorso qualsiasi! Abbiamo scoperto che i neuroni che partono dalla S1HL (principalmente nello strato 5) e arrivano alla BLA sono glutammatergici (cioè usano il glutammato, un neurotrasmettitore eccitatorio). E dove vanno a finire nella BLA? Principalmente su altri neuroni glutammatergici che esprimono anche un neuropeptide chiamato colecistochinina (CCK). Quindi, abbiamo identificato un circuito specifico: S1HLGlu → BLACCK.
4. Iperattività del Circuito “in Diretta”: Non ci siamo fermati alla mappa. Con una tecnica chiamata fotometria a fibra ottica, che permette di misurare l’attività neuronale in tempo reale negli animali mentre si comportano, abbiamo “ascoltato” questo circuito S1HL → BLA. Ebbene, nei topolini con dolore cronico e depressione, questo circuito era significativamente più attivo sia durante la stimolazione dolorosa (anche lieve) sia durante situazioni stressanti (come il nuoto forzato), rispetto ai topi sani o con solo dolore acuto. Era come se questa autostrada fosse diventata iper-trafficata!

La Prova del Nove: Silenziare il Circuito
A questo punto, la domanda era: questa iperattività del circuito S1HLGlu → BLACCK è solo una conseguenza o è la causa dei sintomi depressivi nel contesto del dolore cronico?
Per rispondere, abbiamo usato la chemogenetica. È una tecnica fantastica che ci permette di “accendere” o “spegnere” selettivamente specifici gruppi di neuroni usando un farmaco innocuo (CNO).
Abbiamo fatto due esperimenti chiave:
- Abbiamo inibito specificamente i neuroni della S1HL che proiettano alla BLA.
- Abbiamo inibito specificamente i neuroni della BLA che ricevono input dalla S1HL (quelli CCK+).
I risultati sono stati sbalorditivi! In entrambi i casi, quando abbiamo “silenziato” questo circuito nei topi con dolore cronico e depressione:
- I comportamenti depressivi sono migliorati significativamente! I topi mostravano più interesse per lo zucchero e nuotavano più attivamente.
- Ma – e questo è cruciale – la loro soglia del dolore non è cambiata! Continuavano a sentire il dolore neuropatico allo stesso modo.
Questo ci dice che il circuito S1HLGlu → BLACCK non serve tanto a “sentire” il dolore in sé, quanto a collegare l’esperienza dolorosa cronica allo sviluppo di uno stato emotivo negativo, la depressione. È come se avessimo trovato l’interruttore che accende la depressione quando il dolore persiste troppo a lungo.
Il Ruolo Chiave della CCK
Infine, ci siamo chiesti se la molecola CCK avesse un ruolo attivo in tutto questo. Abbiamo usato un approccio genetico per ridurre specificamente l’espressione di CCK solo nei neuroni della BLA che ricevono input dalla S1HL. Il risultato? Esattamente come con l’inibizione chemogenetica: i sintomi depressivi nei topi con dolore cronico sono migliorati, senza influenzare la percezione del dolore. Questo conferma che la CCK in questi specifici neuroni della BLA è un mediatore chiave degli effetti pro-depressivi di questo circuito iperattivo.
Cosa Significa Tutto Questo?
Beh, per me è una scoperta entusiasmante! Abbiamo identificato un meccanismo neurale specifico, il circuito S1HLGlu → BLACCK, che guida la transizione dal dolore cronico alla depressione comorbida. Abbiamo dimostrato che l’iperattività di questo percorso è fondamentale per lo sviluppo dei sintomi depressivi associati al dolore neuropatico, ma non per il dolore stesso.
Questo non solo ci aiuta a capire meglio come queste due condizioni devastanti siano intrecciate nel cervello, ma apre anche strade completamente nuove per potenziali terapie. Immaginate farmaci o interventi che possano modulare selettivamente questo circuito, magari agendo sulla CCK o sui suoi recettori in quella specifica popolazione di neuroni BLA. Potremmo essere in grado di “scollegare” la depressione dal dolore cronico, offrendo un sollievo mirato a chi soffre di questa difficile comorbilità.
Certo, siamo ancora all’inizio e la ricerca è stata fatta su modelli animali, ma è un passo avanti significativo. È la dimostrazione che capire a fondo i circuiti cerebrali può davvero fare la differenza. E io non vedo l’ora di vedere dove ci porteranno i prossimi passi!
Fonte: Springer