Dissezione Aortica di Tipo A: E se la Chiave Fosse Nascosta in una Nuova Forma di Morte Cellulare?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della ricerca cardiovascolare, un argomento che mi appassiona particolarmente: la dissezione aortica di tipo A (TAAD). Immaginate l’aorta, la nostra autostrada principale del sangue, come un tubo multistrato. Nella TAAD, questi strati si separano, creando una situazione estremamente pericolosa, spesso letale, che richiede interventi chirurgici d’urgenza molto complessi. È una patologia dal decorso catastrofico e, nonostante i progressi, capire a fondo *perché* succede è fondamentale per trovare modi efficaci per prevenirla o trattarla con farmaci mirati.
Il Ruolo Nascosto dell’Infiammazione e una Nuova Protagonista: la Disulfidptosi
Sappiamo da tempo che l’infiammazione gioca un ruolo da protagonista nella TAAD. Le pareti dell’aorta si infiammano, richiamando cellule immunitarie che, nel tentativo di “riparare”, possono in realtà peggiorare la situazione. Ma recentemente è emersa una nuova forma di morte cellulare programmata, chiamata disulfidptosi. Un nome un po’ complicato, lo so, ma pensatela così: le cellule muoiono a causa di uno stress legato a legami chimici specifici (ponti disolfuro) che vanno in tilt, soprattutto quando c’è un accumulo di una sostanza chiamata cistina e una carenza di un’altra molecola energetica (NADPH). Questo processo sembra destabilizzare lo scheletro interno delle cellule (il citoscheletro di actina), portandole al collasso.
La domanda che ci siamo posti è stata: e se questa disulfidptosi fosse coinvolta nella TAAD? E se fosse collegata proprio all’infiammazione e all’infiltrazione di cellule immunitarie che vediamo in questa malattia? Potrebbe essere un pezzo mancante del puzzle?
Caccia ai Geni: Cosa Ci Dicono i Dati
Per investigare questa ipotesi, abbiamo indossato i panni dei detective dei dati. Siamo andati a “scavare” nei database pubblici (come il Gene Expression Omnibus – GEO), che raccolgono montagne di informazioni sull’espressione genica da tessuti umani. Abbiamo confrontato i dati provenienti da campioni di aorta di pazienti con TAAD acuta con quelli di controlli sani. L’obiettivo? Trovare i geni espressi differentemente (DEGs) tra i due gruppi.
Ne abbiamo trovati tantissimi, oltre 13.000! Ma la nostra attenzione si è concentrata su quelli specificamente legati alla disulfidptosi. Incrociando i dati, siamo riusciti a isolare 11 geni legati alla disulfidptosi che si comportavano in modo diverso nei pazienti con TAAD. La cosa interessante? La maggior parte di questi geni (come INF2, CD2AP, PDLIM1, ACTN4, MYH10, MYH9, FLNA, FLNB, TLN1, MYL6, ACTB, DSTN, IQGAP1) erano meno attivi nei tessuti malati rispetto a quelli sani. L’unica eccezione era il gene CAPZB, che invece risultava più espresso.
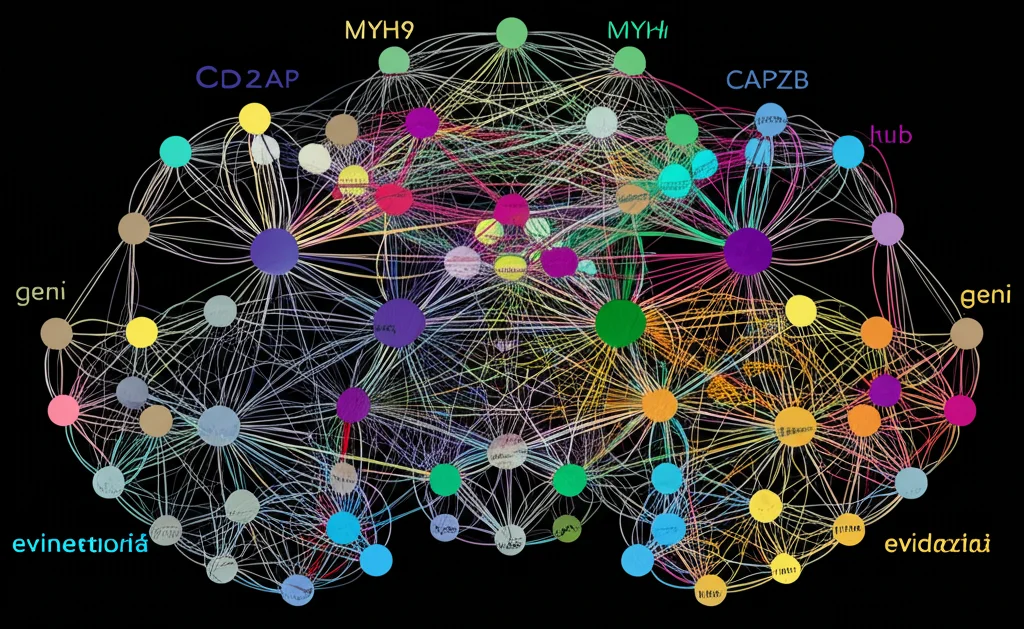
Analizzando le funzioni di questi geni differenziali, abbiamo visto che molti sono coinvolti proprio in processi legati al citoscheletro di actina, ai punti di contatto tra cellule (giunzioni focali, giunzioni strette) e al movimento cellulare. Questo combacia perfettamente con le caratteristiche patologiche della TAAD, dove si osserva perdita di cellule muscolari lisce e degradazione della matrice extracellulare.
Il Sistema Immunitario Entra in Scena
Ma che dire del sistema immunitario? Abbiamo analizzato l’infiltrazione di cellule immunitarie nei tessuti aortici. Ebbene sì, nei campioni TAAD c’era un bel po’ di movimento! Abbiamo trovato livelli più alti di molti tipi di cellule immunitarie rispetto ai controlli sani, tra cui:
- Cellule T CD4+ attivate
- Cellule dendritiche attivate e immature
- Cellule Natural Killer (NK) CD56dim
- Cellule T memoria (centrali e effettrici) CD4+ e CD8+
- Macrofagi
- Monociti
- Neutrofili
- Cellule T regolatorie (Tregs)
- E molte altre…
Questo conferma che la TAAD è una malattia “calda” dal punto di vista immunitario. L’aspetto cruciale è che abbiamo trovato correlazioni tra l’espressione dei nostri 11 geni della disulfidptosi e i livelli di queste cellule immunitarie infiltrate. Sembra proprio che ci sia un dialogo tra questi due processi!
Identikit dei Pazienti e Geni Chiave
Usando tecniche di machine learning (come il clustering di consenso), abbiamo provato a classificare i pazienti TAAD basandoci solo sull’espressione di questi 11 geni. Siamo riusciti a dividerli in due gruppi (cluster C1 e C2). Il cluster C2 mostrava livelli generalmente più alti di espressione di questi geni e, cosa molto interessante, anche livelli significativamente più alti di infiltrazione immunitaria (in particolare cellule T CD8+ memoria, macrofagi, cellule NK T e Tregs) rispetto al cluster C1. Questo suggerisce che i geni legati alla disulfidptosi potrebbero influenzare il “paesaggio” immunitario all’interno dell’aorta malata.
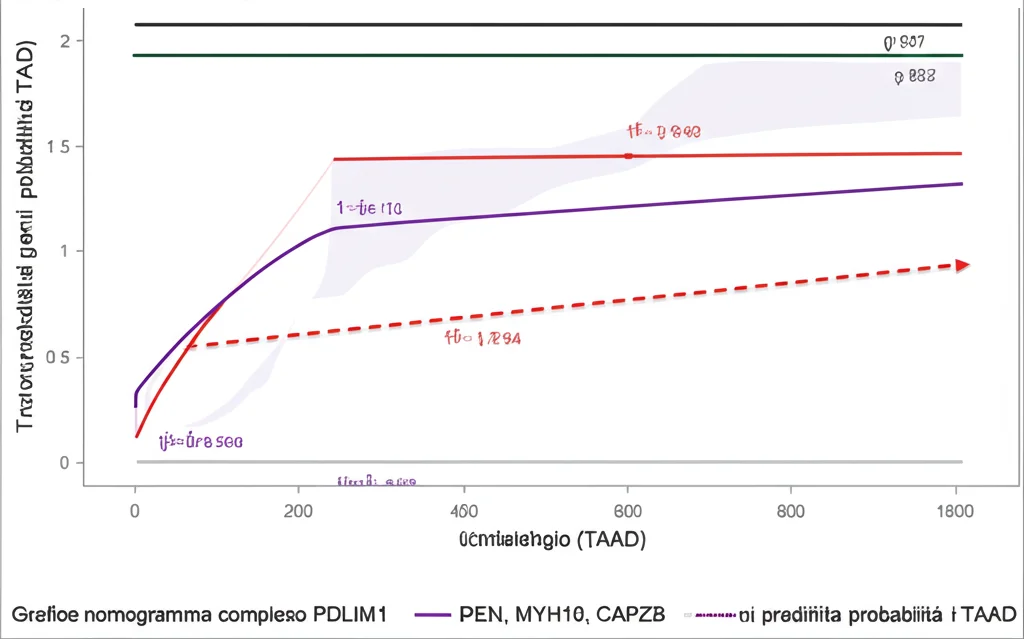
Per stringere ancora di più il cerchio, abbiamo usato un’altra tecnica di machine learning, la regressione LASSO, per identificare i geni “chiave” all’interno del gruppo dei 11, quelli con il maggior potere diagnostico. Ne sono emersi tre: PDLIM1, MYH10 e CAPZB. Questi tre moschettieri sembrano essere particolarmente importanti nel distinguere un’aorta sana da una con dissezione. Abbiamo anche costruito un modello diagnostico basato su questi tre geni che ha mostrato un’ottima capacità predittiva (AUC della curva ROC di 0.950!).
Validazione in Laboratorio: La Prova del Nove
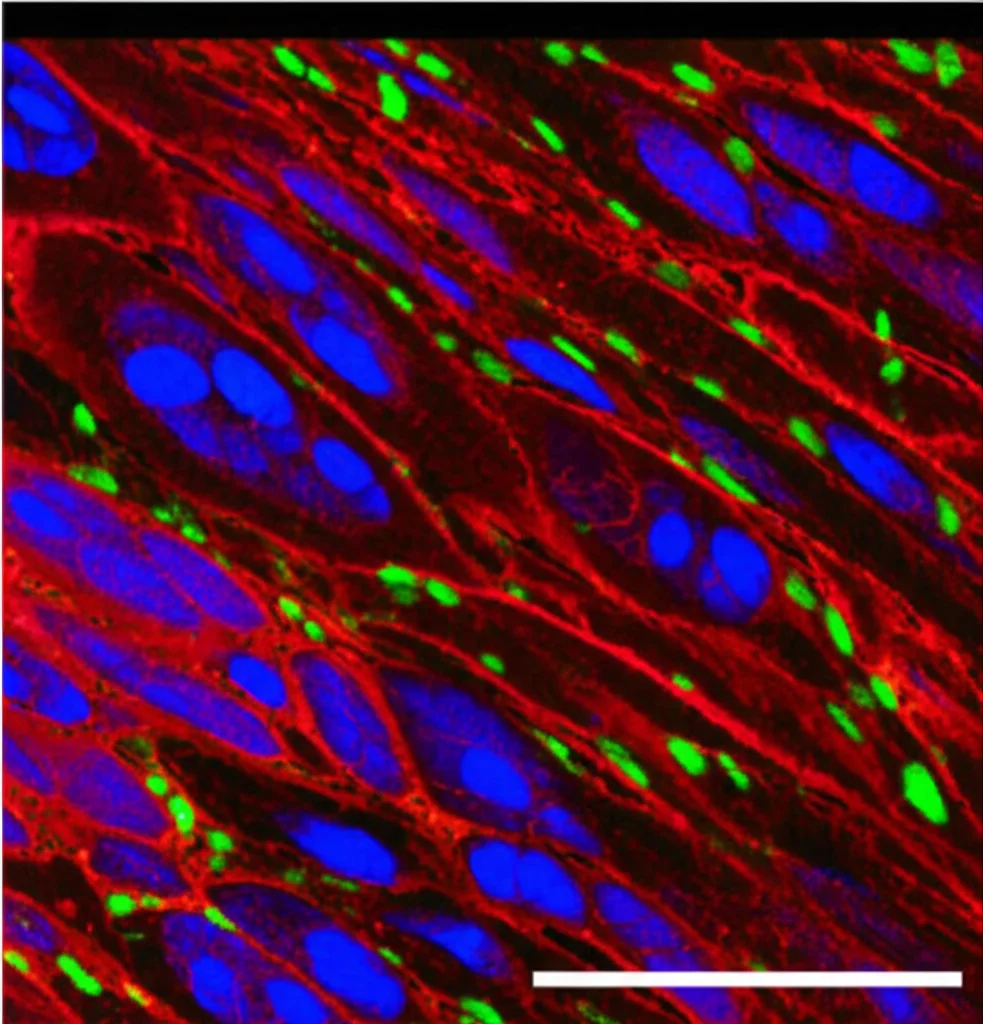
Ovviamente, i dati bioinformatici sono potenti, ma serve una conferma sperimentale. Siamo quindi andati in laboratorio e abbiamo analizzato direttamente campioni di tessuto aortico da pazienti. Utilizzando tecniche come l’immunofluorescenza (che colora specifiche proteine nei tessuti), la RT-qPCR (che misura l’RNA messaggero dei geni) e il Western Blot (che misura le proteine), abbiamo confermato quello che i dati ci dicevano: nei tessuti TAAD, l’espressione di PDLIM1 e MYH10 era effettivamente più bassa, mentre quella di CAPZB era più alta rispetto ai controlli sani. Bingo!
Cosa Significa Tutto Questo? Prospettive Future
Questo studio, pur con i suoi limiti (principalmente legati alla fase acuta della malattia studiata e alla necessità di validazioni su campioni più ampi), apre scenari davvero interessanti. Sembra che la disulfidptosi non sia solo una curiosità biologica, ma un processo che potrebbe attivamente contribuire alla progressione della dissezione aortica di tipo A, probabilmente influenzando la risposta immunitaria e l’attività metabolica all’interno della parete aortica.
I geni che abbiamo identificato, in particolare il trio PDLIM1, MYH10 e CAPZB, non sono solo potenziali biomarcatori per diagnosticare o classificare meglio la TAAD, ma potrebbero rappresentare dei nuovi bersagli terapeutici. Immaginate farmaci in grado di modulare la disulfidptosi o l’attività di questi geni specifici per proteggere l’aorta.
Certo, la strada è ancora lunga. Serviranno ulteriori ricerche per capire esattamente i meccanismi molecolari e per validare questi risultati su larga scala. Ma aver gettato una nuova luce su questa malattia devastante, collegando la disulfidptosi all’immunità nella TAAD, è un passo avanti che ci dà speranza per il futuro. È la bellezza della ricerca: ogni scoperta, anche piccola, può aprire porte inaspettate!
Fonte: Springer