BRCA1 e Cancro al Seno: Il Caos Nascosto Prima della Tempesta Tumorale
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore della biologia del cancro, in particolare quello al seno legato a una mutazione che forse avrete sentito nominare: BRCA1. Sapete, una delle grandi domande nella ricerca sul cancro è: come fa una cellula normale, perfettamente integrata nel suo tessuto, a trasformarsi in una cellula tumorale invasiva? Nel caso del cancro al seno associato a BRCA1, pensiamo che le “colpevoli” iniziali siano le cellule progenitrici luminali, un tipo specifico di cellula della ghiandola mammaria. Ma il percorso esatto che queste cellule intraprendono per diventare cancerose è rimasto a lungo un mistero.
Il Punto di Partenza: Un Disordine Nascosto
Nel nostro studio, abbiamo cercato di ricostruire questa sequenza di eventi. Immaginate di avere una mappa dettagliatissima che vi mostra passo passo cosa succede a livello molecolare. Per crearla, abbiamo combinato dati potentissimi: quelli sull’epigenoma (l’insieme di “istruzioni” che dicono ai geni quando e come attivarsi) e quelli sul trascrittoma (l’insieme dei geni effettivamente attivi in una cellula), il tutto a livello di singola cellula! Questo ci permette di vedere le differenze sottili tra una cellula e l’altra.
Abbiamo usato modelli murini (topolini, per capirci) in cui abbiamo “spento” due geni cruciali: Trp53 (un famoso “guardiano del genoma”) e, ovviamente, Brca1. E qui abbiamo fatto una scoperta sorprendente: anche prima che si formi un tumore visibile, le cellule progenitrici luminali in questi topolini mostrano un esteso disordine epigenomico. È come se le istruzioni su come comportarsi fossero diventate confuse, portando a una perdita della loro identità specifica di cellula luminale. Pensateci: cellule che non sanno più bene chi sono!
La Transizione Verso il Lato Oscuro: L’EMT Parziale
Ma non finisce qui. Queste cellule “confuse” non restano ferme. Progrediscono verso la formazione del tumore attraverso un processo chiamato transizione epitelio-mesenchimale parziale (EMT). Normalmente, le cellule epiteliali (come quelle luminali) sono ben ordinate, attaccate le une alle altre. Durante l’EMT, perdono queste caratteristiche e ne acquisiscono altre tipiche delle cellule mesenchimali, più mobili e invasive. Nel nostro caso, questa transizione è “parziale”: le cellule non diventano completamente mesenchimali, ma si trovano in uno stato intermedio, un po’ epiteliale e un po’ mesenchimale. Questo processo sembra orchestrato da un “direttore d’orchestra” molecolare chiamato Snail, un fattore di trascrizione noto per il suo ruolo nell’EMT.
Contemporaneamente, queste cellule iniziano a “parlare” in modo diverso con il loro microambiente. Attivano segnali che possono sopprimere la risposta immunitaria (come le vie di segnalazione MIF e SPP1) – un trucco astuto per evitare di essere eliminate dal sistema immunitario – e attivano anche la segnalazione FGF (Fibroblast Growth Factor), importante per la crescita e la comunicazione cellulare.
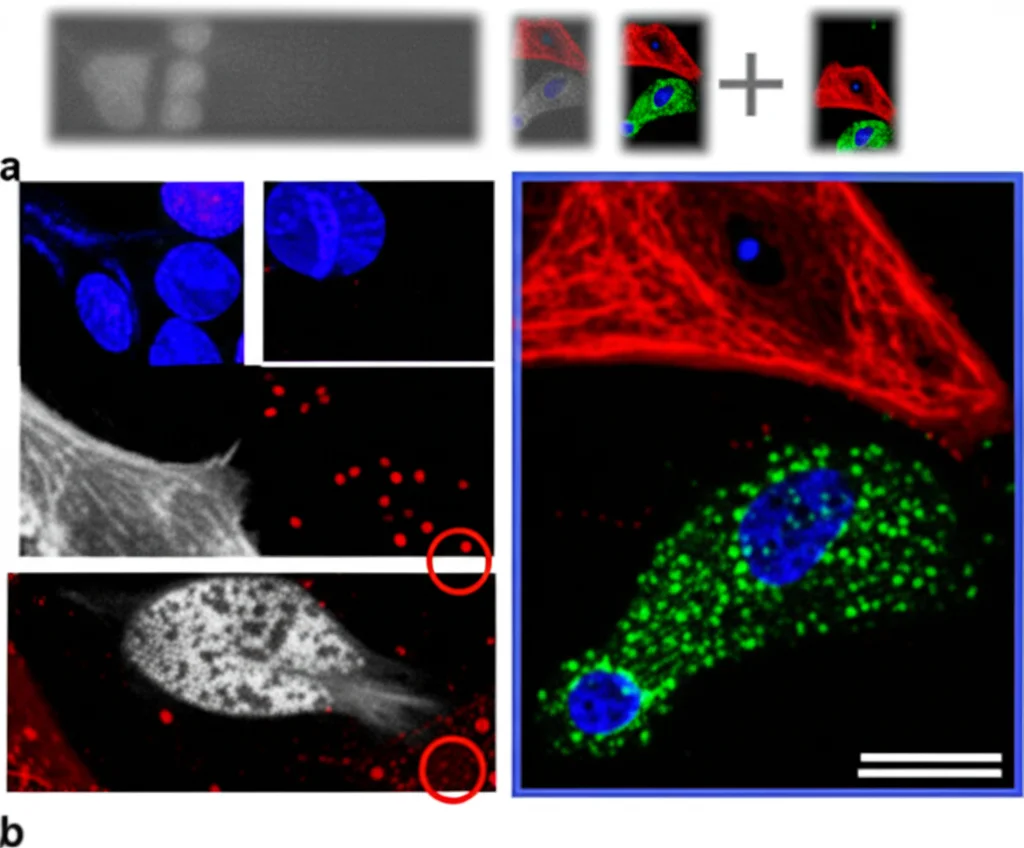
Dagli Studi sui Topi all’Uomo: Ritrovare le Tracce
Ok, tutto questo è molto interessante nei topi, ma cosa significa per le persone? È qui che le cose si fanno davvero eccitanti. Siamo andati a cercare queste “firme” pre-tumorali nei tessuti umani. E le abbiamo trovate!
- Nei tumori al seno umani di tipo basale (il tipo spesso associato a BRCA1), specialmente quelli in stadio iniziale che raramente recidivano, abbiamo visto tracce di questo stato pre-tumorale. Ad esempio, il gene CDKN2A (noto anche come p16), che abbiamo visto essere un marcatore chiave dello stato pre-tumorale nei topi, è particolarmente attivo in questi tumori umani.
- Ancora più incredibile: abbiamo analizzato tessuto mammario “apparentemente normale” prelevato da donne portatrici della mutazione BRCA1 che avevano già sviluppato un cancro (tessuto “giusta-tumorale”). Usando una tecnica avanzatissima chiamata MERFISH, che permette di vedere l’attività di molti geni direttamente nel tessuto, abbiamo identificato cellule progenitrici luminali che mostravano proprio le caratteristiche dello stato pre-tumorale: attivazione di geni legati all’EMT (come VIM), a un ciclo cellulare anomalo (CCND1) e a segnali particolari (IGFBP4).
Queste cellule “sospette” erano presenti in piccole aree, come isole in un mare di tessuto normale.
Perché è Importante? Capire l’Inizio per Prevenire
Capirete che identificare questi cambiamenti precoci è fondamentale. Studiare i tumori quando sono già formati è complesso, è come cercare di capire l’origine di un incendio guardando solo le ceneri. Trovare questi stati intermedi, queste cellule “sulla via del non ritorno”, ci dà indizi cruciali su come inizia il processo.
Abbiamo visto che la perdita di identità cellulare, guidata da un caos a livello epigenomico, sembra essere un passo fondamentale. Le cellule progenitrici luminali, sotto lo stress dell’assenza di Brca1 e Trp53, non solo perdono la loro “bussola” epigenetica (mostrando profili H3K4me1 eterogenei e disordinati), ma iniziano anche ad attivare geni che non dovrebbero, come quelli dello stato pre-tumorale. È come se si preparassero epigeneticamente al cambiamento, prima ancora di attivare completamente i geni.

Lo stato pre-tumorale che abbiamo identificato è raro ma cruciale. Funziona come un “hub”, un passaggio obbligato da cui le cellule normali-simili devono transitare per diventare tumorali. È caratterizzato da questa EMT parziale (con Snail come protagonista iniziale) e da difetti nel ciclo cellulare (con l’attivazione di p16, un marcatore di senescenza e arresto del ciclo, che però queste cellule sembrano riuscire a bypassare, forse proprio grazie all’EMT).
Comunicazioni Pericolose: Il Dialogo con l’Ambiente
Un altro aspetto affascinante è come queste cellule pre-tumorali comunicano. Attivano segnali (MIF, SPP1) per “calmare” le cellule immunitarie, in particolare i macrofagi, creando un ambiente più tollerante alla loro presenza. Inoltre, usano la segnalazione FGF per comunicare tra loro e con altre cellule vicine, come i fibroblasti. È interessante notare che questa segnalazione FGF sembra essere transitoria, più importante nelle fasi iniziali che nel tumore conclamato. E infatti, abbiamo confermato anche nell’uomo che la segnalazione FGF (misurando pFGFR, la forma attivata del recettore) è elevata nel tessuto mammario di portatrici di BRCA1, sia in quelle con tumore che in quelle senza (operate preventivamente), ma non nei tumori stessi.

Verso il Futuro: Monitoraggio e Prevenzione
Insomma, il nostro lavoro dipinge un quadro più chiaro di come le cellule progenitrici luminali, in presenza di mutazioni BRCA1, possano intraprendere il pericoloso cammino verso il cancro. Non è solo una questione di mutazioni genetiche accumulate; è anche una questione di instabilità epigenetica, perdita di identità, attivazione di programmi come l’EMT parziale e un dialogo alterato con l’ambiente circostante.
La scoperta che possiamo rilevare tracce di questi eventi precoci nei tessuti umani, specialmente in quelli di donne ad alto rischio che hanno già avuto un tumore, apre prospettive entusiasmanti. Potremmo un giorno usare queste “firme” molecolari per monitorare le donne portatrici di mutazioni BRCA1, identificando chi è a rischio più imminente e forse intervenendo prima che il tumore si sviluppi pienamente? È ancora presto per dirlo, ma è la direzione verso cui stiamo lavorando. Comprendere questi primi passi è la chiave per sviluppare strategie di prevenzione e diagnosi precoce sempre più efficaci. Un viaggio complesso, ma pieno di speranza!
Fonte: Springer