Alzheimer Ereditario: Abbiamo Trovato la Chiave che Prevede Quando Colpirà?
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona profondamente e che riguarda una malattia purtroppo molto conosciuta: l’Alzheimer. Ma non la forma più comune, quella che arriva in tarda età. Parleremo della sua versione più rara e precoce, quella Autosomica Dominante (ADAD), che può manifestarsi anche prima dei 65 anni. È una forma causata da specifiche mutazioni genetiche nei geni PSEN1, PSEN2 e APP.
Il Mistero dell’Età d’Esordio
Una delle cose più strane dell’ADAD è la variabilità dell’età in cui compaiono i primi sintomi (chiamata Age at Onset – AAO). Chi ha una mutazione nel gene PSEN1 tende ad ammalarsi prima, ma l’età può variare parecchio anche tra chi ha la stessa identica mutazione! Per chi ha mutazioni in PSEN2 o APP, l’esordio è generalmente più tardivo e ancora più variabile. Capire perché succede questo è fondamentale, non solo per aiutare le famiglie colpite da ADAD con previsioni più accurate e terapie personalizzate, ma anche perché potrebbe darci indizi preziosi sulla forma sporadica dell’Alzheimer, quella più diffusa.
Al centro di tutto questo c’è un complesso enzimatico chiamato γ-secretasi (GSEC). Immaginate delle forbici molecolari. I geni PSEN1 e PSEN2 sono le parti “taglienti” di queste forbici. Il loro compito è tagliare un’altra proteina, la Proteina Precursore dell’Amiloide (APP), prodotta dal gene APP. Questo taglio produce dei frammenti chiamati peptidi amiloide-beta (Aβ).
Normalmente, questo processo è ben regolato, ma le mutazioni ADAD fanno “inceppare” le forbici. Il risultato? Un taglio impreciso che produce un mix sbilanciato di peptidi Aβ, con un aumento relativo di quelli più lunghi e “appiccicosi”, come l’Aβ42 e l’Aβ43. Sono proprio questi peptidi che tendono ad aggregarsi formando le famose placche amiloidi nel cervello, considerate uno dei fattori scatenanti della malattia.
La Nostra Indagine: Alla Ricerca di un Modello Unificante
Qui entra in gioco la nostra ricerca. Ci siamo chiesti: e se il *modo* in cui queste mutazioni alterano la funzione della γ-secretasi fosse la chiave per predire l’età d’esordio, indipendentemente dal gene mutato? Avevamo già visto in studi precedenti [23] che per le mutazioni PSEN1 c’era una forte correlazione lineare: più la mutazione “sballava” il rapporto tra peptidi Aβ corti e lunghi (un indicatore della cosiddetta “processività” della GSEC), prima comparivano i sintomi.
Quindi, abbiamo deciso di fare lo stesso tipo di analisi biochimica dettagliata su ben 28 mutazioni del gene PSEN2 e 19 mutazioni del gene APP (specificamente quelle nella regione transmembrana, TMD, che interagisce direttamente con la GSEC). Abbiamo usato cellule in laboratorio per “mimare” l’effetto di queste mutazioni sulla produzione di Aβ.
E i risultati sono stati sorprendenti! Abbiamo scoperto che, proprio come per PSEN1, anche per PSEN2 e APP esiste una correlazione lineare tra l’alterazione del profilo Aβ (cioè il rapporto tra i diversi tipi di peptidi) e l’età media d’esordio dei pazienti portatori di quella specifica mutazione. Per PSEN2, la correlazione (R²) era 0.52, mentre per APP era ancora più forte, 0.69.
Binari Paralleli: Stesso Meccanismo, Tempi Diversi
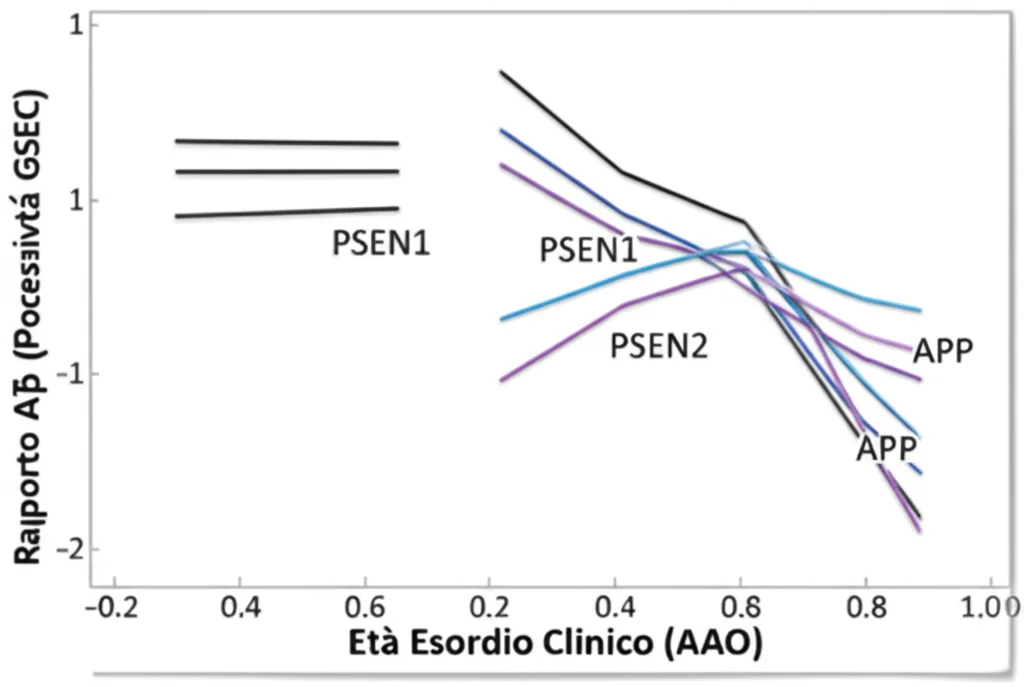
La cosa ancora più affascinante è successa quando abbiamo messo insieme i dati di tutti e tre i geni (PSEN1, PSEN2, APP). Immaginate un grafico con l’alterazione Aβ sull’asse X e l’età d’esordio sull’asse Y. Abbiamo ottenuto tre linee di correlazione quasi parallele, ma “spostate” verticalmente l’una rispetto all’altra!
Cosa significa? Che il meccanismo di base legato alla disfunzione della GSEC e all’alterazione dei peptidi Aβ è comune a tutte e tre le forme genetiche di ADAD (le linee hanno pendenze simili). Tuttavia, il punto di partenza, l’età “base” d’esordio per un dato livello di disfunzione, è diverso per ciascun gene (le intercette sull’asse Y sono diverse).
Quantificando queste differenze, abbiamo calcolato che, a parità di “danno” biochimico misurato sui profili Aβ, le mutazioni in PSEN2 portano a un esordio mediamente 27 anni più tardi rispetto a PSEN1, mentre quelle in APP lo ritardano di circa 8 anni.
Perché PSEN2 Ritarda l’Esordio? Un Paradosso Apparente
Ma come è possibile che le mutazioni PSEN2, che spesso causano profili Aβ “brutti” simili a quelli di PSEN1, portino a un esordio così posticipato? La nostra ipotesi, supportata da altri studi [6, 41], è che le GSEC che contengono PSEN2 siano semplicemente meno “presenti” o meno efficienti nel processare l’APP nel cervello rispetto a quelle con PSEN1. Rappresentano una frazione minore dell’attività totale. Quindi, anche se la mutazione altera il rapporto Aβ in modo patogeno, l’impatto complessivo sulla produzione totale di Aβ “cattivo” è minore, ritardando l’accumulo e l’esordio della malattia.
A sostegno di questa idea c’è un dato interessante che riguarda proprio PSEN1. Abbiamo analizzato alcune mutazioni PSEN1 estremamente “inattivanti”, che non solo alterano il rapporto Aβ, ma riducono drasticamente l’attività generale della GSEC (oltre l’85% di inattivazione). Ebbene, anche queste mutazioni, pur essendo biochimicamente “gravi” in termini di rapporto Aβ, sono associate a un esordio clinico significativamente ritardato (spesso oltre 20 anni!) rispetto a quanto prevedrebbe la correlazione generale di PSEN1. Sembra quasi un paradosso: un danno estremo che attenua l’impatto finale. Questo suggerisce che una ridotta *quantità* di processamento dell’APP, anche se “sbagliato”, possa ritardare la malattia.
Prevedere l’Imprevedibile e Capire le Eccezioni
Questa scoperta ha implicazioni enormi. Innanzitutto, ci fornisce un modello quantitativo unificato che lega la biochimica della GSEC all’età d’esordio per tutte le forme di ADAD. Questo ci permette di:
- Valutare la patogenicità di nuove mutazioni o di quelle classificate come “di significato incerto”. Se una mutazione altera significativamente i rapporti Aβ nel nostro test, è probabile che sia patogenica. Ad esempio, abbiamo identificato diverse mutazioni PSEN2 precedentemente incerte che ora possiamo considerare probabilmente patogeniche, mentre altre sembrano benigne.
- Predire un’età d’esordio “biochimica” per ciascuna mutazione. Questo valore di riferimento è preziosissimo. Confrontandolo con l’età d’esordio clinica reale dei singoli pazienti, possiamo identificare casi “anomali”.
- Identificare potenziali fattori modificatori. Se un paziente con una certa mutazione sviluppa la malattia molto prima o molto dopo l’età predetta dalla biochimica, potrebbe avere altri fattori genetici o ambientali che accelerano o rallentano la malattia. Studiare questi casi “estremi” (come la famosa famiglia colombiana con la mutazione PSEN1-E280A e il caso protettivo della mutazione APOE Christchurch [44]) è cruciale per scoprire nuovi meccanismi di malattia e protezione. Abbiamo notato, ad esempio, che molti portatori di mutazioni APP tendono ad avere un esordio anticipato rispetto alla previsione biochimica, mentre per PSEN2 (come nella variante N141I Volga) ci sono famiglie con esordi notevolmente posticipati. Questo apre la porta a studi futuri su meccanismi come l’espressione differenziale degli alleli mutati o la ricombinazione somatica del gene APP [46, 47].
Verso Nuove Terapie?
Infine, questa ricerca rafforza l’idea che modulare l’attività della γ-secretasi potrebbe essere una strategia terapeutica valida. La pendenza delle nostre linee di correlazione suggerisce che anche piccoli miglioramenti nel profilo Aβ potrebbero tradursi in ritardi significativi dell’età d’esordio. Ad esempio, per PSEN1, un miglioramento del 12% nel rapporto Aβ potrebbe ritardare l’esordio di circa 5 anni!
Questo dà speranza per lo sviluppo di farmaci chiamati Modulatori della γ-secretasi (GSMs) [50]. Questi composti mirano a “correggere” il taglio dell’APP, spostando la produzione verso peptidi Aβ più corti e meno dannosi, senza bloccare completamente l’enzima (che ha anche funzioni vitali). Un GSM di seconda generazione è già in fase avanzata di sperimentazione clinica.
Il nostro modello suggerisce che tali terapie potrebbero essere efficaci per tutte le forme di ADAD, anche se forse andrebbero iniziate prima nei portatori di mutazioni PSEN1. E, cosa ancora più eccitante, potrebbero avere un potenziale anche per la forma sporadica di Alzheimer, dove un accumulo progressivo di Aβ più lunghi sembra giocare un ruolo chiave, magari a causa di problemi di “smaltimento” [49]. Stabilizzare la GSEC con i GSM potrebbe limitare la produzione di questi peptidi tossici fin dall’inizio.
Certo, la strada è ancora lunga. I nostri studi sono fatti su modelli cellulari e la biologia del cervello umano è molto più complessa. Inoltre, l’Alzheimer non è solo Aβ; ci sono la proteina tau, l’infiammazione e tanti altri fattori. Ma aver trovato questo filo conduttore, questa capacità della disfunzione della γ-secretasi di predire l’età d’esordio attraverso i diversi geni causali, è un passo avanti importantissimo. Ci dà una base solida per capire meglio la malattia, per personalizzare l’assistenza ai pazienti e per sviluppare terapie più mirate. E questa, per me, è scienza che dà speranza.
Fonte: Springer