Alzheimer: E se la Diagnosi Fosse Quantistica? Vi racconto la mia ultima scoperta!
Ciao a tutti! Oggi voglio parlarvi di una sfida che mi sta particolarmente a cuore e che, come sapete, affligge milioni di persone e le loro famiglie: la malattia di Alzheimer. È una forma comune di demenza, e le proiezioni dicono che la sua prevalenza potrebbe triplicare nei prossimi cinquant’anni. Un vero e proprio tsunami sanitario ed emotivo. La malattia spesso inizia in modo subdolo, con lievi difficoltà cognitive (il cosiddetto Mild Cognitive Impairment o MCI), che non impediscono ancora di vivere una vita normale. Ma ogni anno, una percentuale significativa di persone con MCI scivola verso l’Alzheimer conclamato, con una perdita progressiva di autonomia fino alla dipendenza totale.
Nonostante non esista ancora una cura definitiva, alcuni farmaci possono rallentare la comparsa dei sintomi, e questo rende la diagnosi precoce assolutamente fondamentale. Il problema? I primi sintomi vengono spesso confusi con il normale invecchiamento. Per questo, quando c’è un sospetto, si attivano una serie di esami, inclusa la neuroimaging e test neuropsicologici. Tra gli strumenti a nostra disposizione c’è l’elettroencefalogramma (EEG), che registra l’attività elettrica del cervello. È noto che l’EEG si altera in caso di MCI e Alzheimer, mostrando un rallentamento delle onde cerebrali, una ridotta complessità e problemi di sincronizzazione. C’è persino una forte correlazione tra i punteggi EEG e la gravità della demenza.
Tuttavia, l’interpretazione manuale dell’EEG è un processo lungo, faticoso e soggetto a inevitabili soggettività umane. Inoltre, c’è una notevole variabilità nei tracciati EEG tra i pazienti con Alzheimer, il che rende difficile identificare dei “marcatori” universali per una diagnosi precoce affidabile. È qui che entriamo in gioco noi ricercatori, armati di algoritmi e tanta passione!
Una Scintilla Quantistica per l’EEG
Negli ultimi anni, l’intelligenza artificiale e il machine learning hanno aperto strade promettenti per sviluppare modelli automatici di rilevamento dell’Alzheimer basati sull’EEG. In parallelo, i sistemi di registrazione EEG sono diventati più accessibili e persino portatili. Questo fa dell’EEG uno strumento davvero interessante per lo screening e la diagnosi precoce, specialmente nelle popolazioni a rischio.
Nel mio ultimo studio, ho voluto fare un passo in più. Mi sono chiesto: e se potessimo creare un modello che fosse non solo accurato, ma anche computazionalmente efficiente, magari traendo ispirazione da concetti della fisica quantistica? So che suona un po’ fantascientifico, ma seguitemi! L’idea era di sviluppare una nuova funzione per estrarre le caratteristiche (features) significative dai segnali EEG, qualcosa di innovativo.
Abbiamo quindi analizzato retrospettivamente i tracciati EEG di 134 pazienti con Alzheimer e 113 persone non affette dalla malattia. Per prima cosa, abbiamo “scomposto” i segnali EEG usando una tecnica chiamata trasformata wavelet discreta multilivello (MDWT), un po’ come separare i diversi strumenti in un’orchestra per analizzarli meglio. Poi, è arrivata la parte “quantistica”.
Il Grafo di Goldner-Harary Entra in Scena
Ci siamo ispirati al concetto di superposizione della fisica quantistica, secondo cui un sistema quantistico può esistere in più stati contemporaneamente finché non viene misurato. Abbiamo quindi ideato una nuova funzione di estrazione delle caratteristiche basata su sette diversi sottografi derivabili da un particolare schema matematico chiamato grafo di Goldner-Harary (GHPat). Pensate a questi sottografi come a diversi “stati quantistici” potenziali.
Per ogni blocco di segnale EEG in ingresso, abbiamo utilizzato una funzione di “fitness” basata sulla distanza (ispirata all’algoritmo Forward-Forward di Hinton, una leggenda nel campo dell’IA) per selezionare selettivamente uno specifico sottografo. Questo approccio, che mima più realisticamente i sistemi neurali umani, ci ha permesso di estrarre caratteristiche “testuali” in modo simile alla tecnica Local Binary Pattern (LBP), ma con un tocco quantistico. Insieme a queste, abbiamo estratto anche caratteristiche statistiche più classiche. L’unione di queste due tipologie di informazioni ci ha fornito un set di dati ricco e dettagliato per ogni paziente.

Il nostro modello, che abbiamo chiamato GHPat, non si ferma qui. Include anche altri componenti intelligenti:
- Una fase di selezione delle caratteristiche chiamata Iterative Neighborhood Component Analysis (INCA), per scegliere solo le informazioni più discriminanti.
- Un classificatore standard ma efficace, il k-Nearest Neighbors (kNN).
- E per finire, un sistema di Iterative Majority Voting (IMV) e un algoritmo “greedy” (ingordo, nel senso buono!) per generare ulteriori previsioni e selezionare il risultato complessivamente migliore.
Abbiamo addestrato e validato il nostro GHPat su un ampio dataset di segnali EEG a 20 canali, utilizzando una strategia di validazione incrociata molto rigorosa chiamata Leave-One-Subject-Out (LOSO CV). Questo metodo è importante perché tiene conto delle differenze tra i singoli soggetti, simulando meglio le applicazioni diagnostiche nella vita reale.
Risultati che Fanno Ben Sperare e Spiegazioni Visive
E i risultati? Sono stati davvero incoraggianti! Il nostro modello GHPat ha raggiunto un’accuratezza dell’88,17%. Un dato notevole, soprattutto considerando l’efficienza computazionale del sistema. Ma non ci siamo accontentati dei numeri. Abbiamo voluto capire di più.
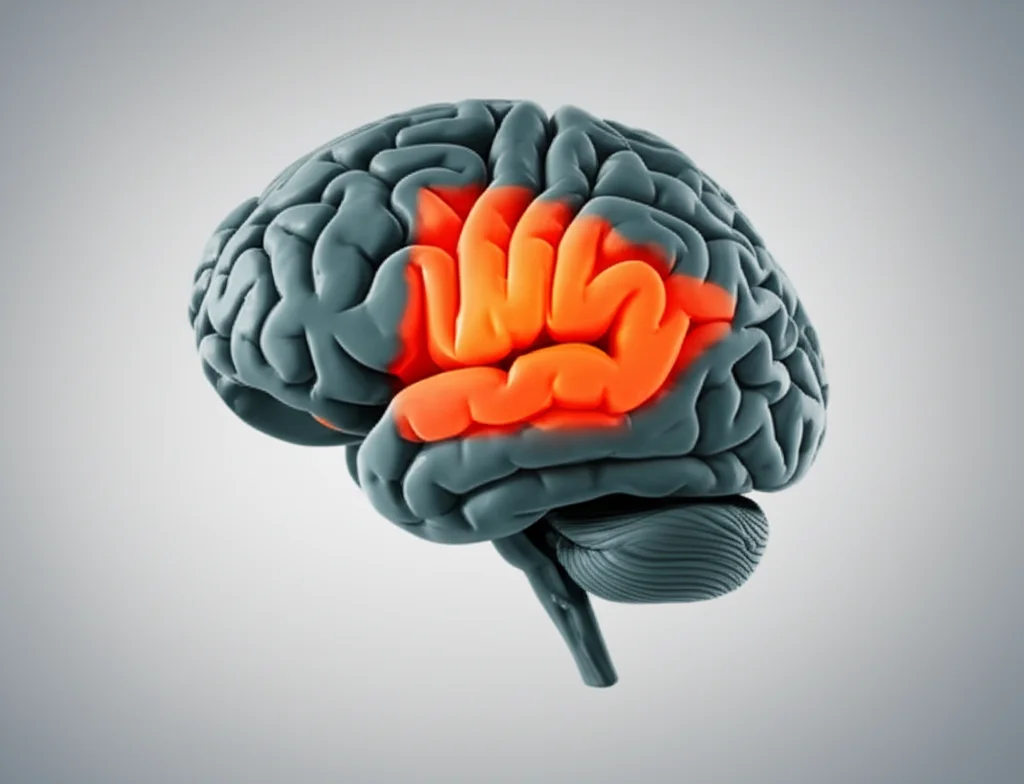
Analizzando i risultati canale per canale, abbiamo scoperto che il canale P4 (situato sulla regione parietale destra del cervello) e, più in generale, la regione parietale sembravano essere le più impattanti, quelle che fornivano le informazioni più utili per la diagnosi. Questo è interessante perché, sebbene tradizionalmente si pensi che l’Alzheimer inizi a colpire la neocorteccia, la corteccia entorinale e l’ippocampo nel lobo temporale, studi di imaging metabolico (come PET e SPECT) suggeriscono che la patologia potrebbe originare proprio dalla giunzione temporo-parietale e dalla regione parietale mediale. I nostri risultati con l’EEG sembrano quindi allinearsi con queste osservazioni più recenti.
Un altro aspetto che mi entusiasma del nostro lavoro è l’interpretabilità. Abbiamo generato delle “mappe corticali” che permettono di correlare visivamente i risultati canale per canale con le varie regioni cerebrali. Questo non solo aiuta a capire meglio come funziona il modello, ma offre anche spunti preziosi sulle correlazioni clinico-patologiche. Vedere queste mappe, con le aree più “attive” evidenziate, rende il tutto molto più tangibile.

Abbiamo anche confrontato il nostro GHPat con altri metodi esistenti, e i risultati sono stati molto positivi, superando spesso in accuratezza altri approcci, pur mantenendo una leggerezza computazionale. Ad esempio, in studi di “ablazione” (dove abbiamo testato i singoli componenti del modello), il GHPat da solo ha mostrato prestazioni significativamente migliori rispetto all’estrazione di sole caratteristiche statistiche o al metodo LBP standard.
Novità e Contributi del Nostro Lavoro
Credo che il nostro studio porti con sé diverse novità e contributi importanti:
- Abbiamo introdotto una nuova funzione di estrazione di caratteristiche ispirata alla quantistica e basata su grafi, specificamente per i segnali EEG nell’ambito dell’Alzheimer. È un approccio originale che fonde reti feedforward con l’estrazione di caratteristiche “artigianali” basate su grafi.
- Abbiamo utilizzato un dataset EEG piuttosto ampio (247 soggetti), il che supporta la generalizzabilità dei nostri risultati. Molti studi esistenti si basano su campioni più piccoli.
- La strategia di validazione LOSO CV rende i nostri risultati più affidabili per un’eventuale applicazione clinica su singoli pazienti.
- Il modello è auto-organizzato grazie all’uso dell’IMV e dell’algoritmo greedy, che selezionano automaticamente i risultati migliori.
- Le mappe corticali offrono una spiegazione visiva dei risultati, migliorando l’interpretabilità del modello, un aspetto cruciale quando si tratta di salute.
Certo, come ogni ricerca, anche la nostra ha delle limitazioni. Il dataset, seppur ampio, è specifico di una certa popolazione, e testare il modello su dati ancora più grandi e diversificati (includendo diversi stadi della malattia e gruppi demografici) sarà fondamentale per migliorarne ulteriormente la robustezza. Inoltre, mentre le architetture di deep learning spesso ottengono alte prestazioni a costo di una grande complessità computazionale, il nostro obiettivo era proprio quello di presentare un modello leggero e accurato.
Guardando al Futuro
Cosa ci riserva il futuro? Beh, abbiamo già diverse idee! Vogliamo espandere la nostra ricerca raccogliendo un dataset EEG ancora più grande, con più partecipanti e magari includendo diverse categorie di deterioramento cognitivo. Puntiamo anche a sviluppare pattern grafici di ispirazione quantistica di nuova generazione, utilizzando grafi ancora più complessi. E perché no, esplorare il potenziale di modelli di deep learning basati su pattern quantistici, come le reti neurali convoluzionali, per affinare ulteriormente le nostre capacità di classificazione.
In conclusione, con questo studio presentiamo un modello di feature engineering innovativo che combina l’estrazione di caratteristiche GHPat di ispirazione quantistica con un’architettura auto-organizzata per il rilevamento dell’Alzheimer tramite segnali EEG. Le elevate accuratezze ottenute, insieme alla leggerezza computazionale e all’interpretabilità, ci fanno sperare che il nostro GHPat possa rappresentare un passo avanti significativo. È un contributo che speriamo possa arricchire il crescente corpo di conoscenze sulla diagnosi dell’Alzheimer e, chissà, un giorno aiutare concretamente nella pratica clinica. La strada è ancora lunga, ma ogni piccolo progresso ci avvicina all’obiettivo!
Fonte: Springer