Diabete e Metformina: Un Duo Inaspettato nella Lotta al Cancro al Seno via Cuproptosi e Ferroptosi?
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante ai confini della ricerca oncologica, un luogo dove condizioni comuni come il diabete e farmaci noti come la metformina si intrecciano in modi sorprendenti con la battaglia contro il cancro al seno. Sappiamo che il cancro al seno è una delle neoplasie più diffuse tra le donne a livello globale, e purtroppo, per le pazienti che convivono anche con il diabete, la prognosi può essere più complicata. Ma cosa succederebbe se un farmaco comunemente usato per il diabete avesse un asso nella manica contro il cancro?
Un Mistero Chiamato Metformina
La metformina è il farmaco d’elezione per molti pazienti diabetici. Ma da tempo, nella comunità scientifica, serpeggia un’ipotesi intrigante: potrebbe avere anche effetti anti-tumorali? Gli studi finora hanno dato risultati contrastanti. Sembra che in persone non diabetiche, la metformina non faccia una gran differenza sulla sopravvivenza legata al cancro al seno. Tuttavia, alcune ricerche suggeriscono che nelle donne diabetiche in post-menopausa, chi assume metformina ha un rischio minore di sviluppare cancro al seno invasivo rispetto a chi usa altri farmaci. Addirittura, uno studio importante (l’ALTTO Phase III) ha mostrato tassi di sopravvivenza migliori nelle pazienti diabetiche con cancro al seno trattate con metformina durante la chemioterapia. Insomma, il legame tra metformina, diabete e cancro al seno è complesso e meritava un’indagine più approfondita.
Entrano in Scena: Cuproptosi e Ferroptosi
Qui le cose si fanno ancora più interessanti. Recentemente, la scienza ha identificato nuovi modi in cui le cellule possono morire, diversi dalla più nota apoptosi. Due di questi meccanismi emergenti sono la cuproptosi (una morte cellulare dipendente dal rame e dalla funzione mitocondriale) e la ferroptosi (legata al ferro e allo stress ossidativo sui lipidi cellulari). Perché sono importanti? Perché le cellule tumorali hanno un metabolismo “impazzito” e spesso accumulano metalli come ferro e rame in quantità maggiori rispetto alle cellule sane. Potremmo sfruttare questa loro “avidità” di metalli per indurle all’autodistruzione?
È noto che la metformina può indurre la ferroptosi nelle cellule di cancro al seno. Data la somiglianza tra ferroptosi e cuproptosi, e sapendo che la metformina agisce anche sui mitocondri e sullo stress ossidativo, ci siamo chiesti: e se la metformina influenzasse anche la cuproptosi? Potrebbe questo farmaco attivare contemporaneamente due diversi “interruttori” di morte nelle cellule tumorali, specialmente in quelle già “stressate” dal contesto diabetico?
La Nostra Indagine al Microscopio
Per vederci chiaro, abbiamo intrapreso uno studio retrospettivo, approvato dal comitato etico locale (XZXY-LK-20240723-0121). Abbiamo analizzato campioni di tessuto tumorale prelevati chirurgicamente da 16 pazienti con cancro al seno diagnosticate nel 2018 presso l’Ospedale Centrale di Xuzhou. Di queste, 5 non erano diabetiche, mentre 11 avevano il diabete. Tra le pazienti diabetiche, 6 erano in trattamento con metformina da almeno due anni, mentre 5 assumevano altre terapie ipoglicemizzanti.
Utilizzando una tecnica chiamata immunoistochimica (IHC), siamo andati a “colorare” specifiche proteine all’interno di questi campioni tumorali, proteine che sono veri e propri indicatori (marker) dei processi che ci interessavano:
- Marker di cuproptosi: FDX1 e DLAT
- Marker di ferroptosi: ACSL4 e GPX4
- Marker del metabolismo del glucosio (glicolisi): LDHA e PKM2
Abbiamo poi quantificato l’intensità di questa colorazione per capire quanto fossero espressi questi marker nei diversi gruppi di pazienti.
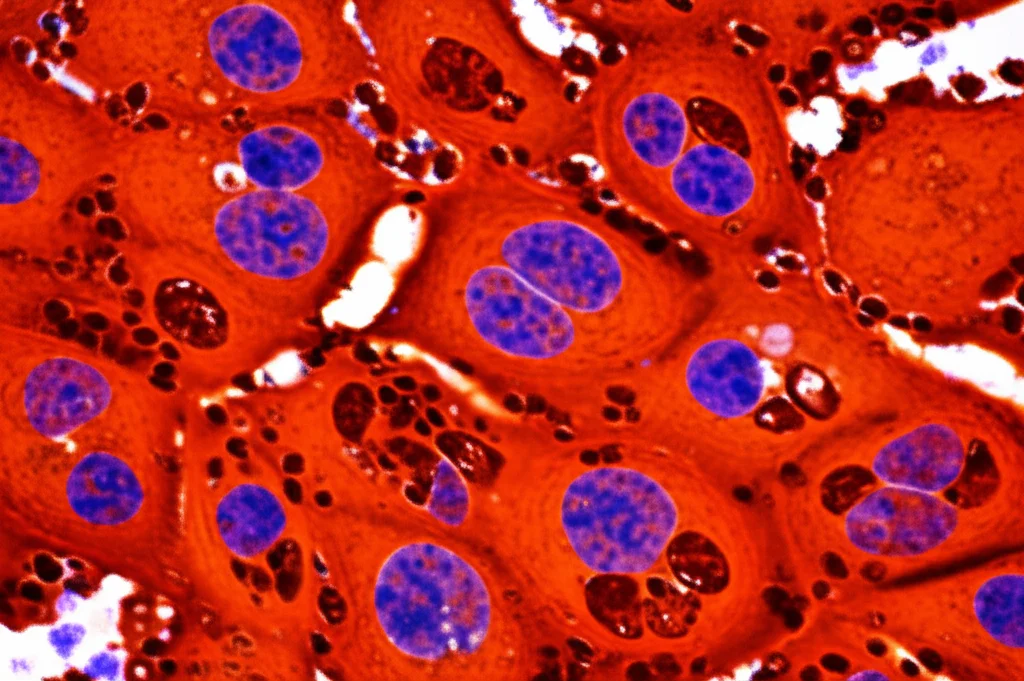
Risultati Sorprendenti: La Metformina Accende i Motori della Morte Cellulare?
Confrontando i gruppi, sono emerse differenze significative proprio dove sospettavamo. Le pazienti diabetiche trattate con metformina mostravano livelli decisamente più alti di FDX1 (il marcatore chiave della cuproptosi) e di ACSL4 (un promotore della ferroptosi) rispetto sia alle pazienti diabetiche non trattate con metformina, sia alle pazienti non diabetiche. Allo stesso tempo, in queste pazienti, i livelli di GPX4 (una proteina che invece *protegge* dalla ferroptosi) tendevano ad essere più bassi, anche se la differenza non era statisticamente schiacciante per quest’ultimo.
Cosa significa tutto questo? Sembra proprio che la metformina, nel contesto del diabete e del cancro al seno, possa potenziare simultaneamente sia la via della cuproptosi che quella della ferroptosi. È come se premesse due pulsanti diversi che portano allo stesso risultato: spingere le cellule tumorali verso l’autodistruzione.
Abbiamo anche osservato che l’espressione di LDHA, un enzima chiave della glicolisi (il processo che le cellule tumorali usano massicciamente per produrre energia, noto come effetto Warburg), era significativamente più bassa nel gruppo metformina. Questo conferma che la metformina “rallenta” il metabolismo energetico preferito dal tumore, il che potrebbe renderlo più vulnerabile ad altri attacchi, come appunto la cuproptosi.
FDX1: Un Possibile Indicatore di Sopravvivenza
Un altro risultato davvero incoraggiante riguarda la sopravvivenza. Analizzando i dati nel tempo (con un’analisi chiamata Kaplan-Meier), abbiamo scoperto che le pazienti i cui tumori mostravano alti livelli di FDX1 (il marcatore di cuproptosi potenziato dalla metformina) avevano una sopravvivenza significativamente più lunga rispetto a quelle con bassi livelli di FDX1. Questo suggerisce che FDX1 non solo è coinvolto nel meccanismo d’azione della metformina, ma potrebbe anche essere un marcatore prognostico: più FDX1 c’è, migliore potrebbe essere l’esito per la paziente.
Un Intreccio Complesso: Cuproptosi, Ferroptosi e Metabolismo
L’analisi delle correlazioni ha ulteriormente rafforzato il quadro. Abbiamo trovato una correlazione positiva tra i livelli di ACSL4 (ferroptosi) e FDX1 (cuproptosi). Questo legame molecolare suggerisce che questi due percorsi di morte cellulare non siano compartimenti stagni, ma possano “parlarsi” e influenzarsi a vicenda, specialmente sotto l’effetto della metformina. La metformina, inibendo la funzione mitocondriale (in particolare il complesso I) e alterando il metabolismo cellulare (riducendo la glicolisi e inducendo stress energetico), crea le condizioni ideali affinché sia l’accumulo di rame (per la cuproptosi, legandosi a proteine specifiche come quelle regolate da FDX1) sia l’accumulo di perossidi lipidici (per la ferroptosi, facilitato da ACSL4 e sfavorito da un possibile calo di GPX4) diventino letali per la cellula tumorale.
Limiti e Prospettive Future
Certo, il nostro studio ha dei limiti. Il numero di pazienti analizzate (16) è piccolo, e questo richiede cautela nell’interpretare i risultati. Serviranno studi più ampi per confermare queste scoperte. Inoltre, la presenza stessa del diabete è un fattore confondente. Tuttavia, i segnali che abbiamo colto sono forti e aprono scenari entusiasmanti.
Questi risultati suggeriscono che l’effetto benefico della metformina nel cancro al seno, specialmente nelle pazienti diabetiche, potrebbe passare proprio attraverso l’induzione combinata di cuproptosi e ferroptosi. Capire a fondo questi meccanismi potrebbe portare allo sviluppo di nuove strategie terapeutiche, magari combinando la metformina con farmaci che agiscono specificamente su queste vie di morte cellulare o utilizzando FDX1 come biomarcatore per personalizzare i trattamenti.
È un campo di ricerca in pieno fermento, e anche se la strada è ancora lunga, studi come questo ci danno la speranza che, comprendendo meglio le vulnerabilità metaboliche del cancro, potremo trovare armi sempre più efficaci per combatterlo. Continueremo a indagare!
Fonte: Springer