DGlyTAC: Le Forbici Molecolari che Disarmano il Cancro Togliendo lo “Zucchero”!
Ciao a tutti! Oggi voglio parlarvi di una cosa davvero affascinante che sta emergendo nel campo della lotta contro il cancro: l’immunoterapia. Sapete, il nostro sistema immunitario è un guerriero incredibile, capace di riconoscere e distruggere le cellule tumorali. Ma a volte, queste cellule maligne sono furbe e sviluppano degli “scudi” per nascondersi o addirittura per spegnere la risposta immunitaria. Questi scudi sono spesso delle proteine chiamate checkpoint immunitari.
Negli ultimi anni, abbiamo fatto passi da gigante sviluppando farmaci, gli inibitori dei checkpoint immunitari (ICI), che bloccano questi scudi, permettendo al nostro sistema immunitario di tornare all’attacco. Questa strategia è stata così rivoluzionaria da meritare il Premio Nobel nel 2018! Fantastico, vero? Però, come spesso accade nella scienza, c’è sempre spazio per migliorare. Gli ICI funzionano legandosi a queste proteine scudo, ma devono essere presenti in concentrazioni elevate e costanti per fare il loro lavoro, e a volte non basta.
Ma se ci fosse un altro modo per disattivare questi scudi?
Qui entra in gioco un processo biologico fondamentale chiamato N-glicosilazione. In parole povere, è come se le cellule attaccassero delle catene di zuccheri (chiamate N-glicani) a molte delle loro proteine, specialmente quelle sulla superficie esterna. Questa “decorazione” zuccherina non è solo estetica: è cruciale per la stabilità delle proteine, per come interagiscono con altre cellule e, indovinate un po’, proprio per la funzione di molti checkpoint immunitari!
Abbiamo scoperto che proteine come PD-L1, CD24, CD47 – nomi noti nel mondo dei checkpoint – hanno bisogno di questi N-glicani per funzionare correttamente e per “ingannare” le nostre cellule immunitarie. Quindi, l’idea è sorta spontanea: e se potessimo semplicemente *rimuovere* questi N-glicani in modo mirato solo dalle proteine scudo del tumore? Sarebbe come togliere le munizioni al nemico, rendendolo inoffensivo!
Il problema, fino ad ora, era la mancanza di una tecnica che potesse farlo in modo specifico. Non vogliamo certo andare a rimuovere gli zuccheri da tutte le proteine della cellula, sarebbe un disastro!
Ecco DGlyTAC: La Nostra Soluzione Intelligente!
Ed è qui che entra in scena la nostra idea, che abbiamo chiamato DGlyTAC (Deglycosylation Targeting Chimera). Lo so, il nome suona complicato, ma il concetto è geniale nella sua semplicità. Abbiamo creato una proteina “chimera”, cioè fatta da due parti diverse unite insieme:
- Una parte è un nanocorpo (Nb) o un affibody (Af): queste sono molecole piccolissime, derivate da anticorpi o altre proteine, capaci di riconoscere e legarsi con altissima specificità a una proteina bersaglio (il nostro checkpoint immunitario). È come un GPS molecolare.
- L’altra parte è un enzima chiamato Peptide-N-glicosidasi F (PNGase F): questo enzima è un vero e proprio “taglia-zuccheri”, capace di staccare gli N-glicani dalle proteine. Sono le nostre forbici molecolari.
Mettendo insieme il GPS (Nb/Af) e le forbici (PNGase F), abbiamo creato DGlyTAC: una molecola che va a cercare *specificamente* la proteina scudo sulla cellula tumorale e, una volta trovata, le taglia via i suoi N-glicani essenziali, disattivandola!
Il bello è che questa tecnica è incredibilmente precisa. Abbiamo dimostrato che i nostri DGlyTAC riescono a rimuovere gli N-glicani dal bersaglio desiderato (abbiamo testato su CD24, CD47, PD-L1 e anche su recettori di crescita come EGFR e HER2) senza toccare in modo significativo gli N-glicani delle altre proteine di membrana. Massima efficacia sul bersaglio, minimi effetti collaterali sul resto.
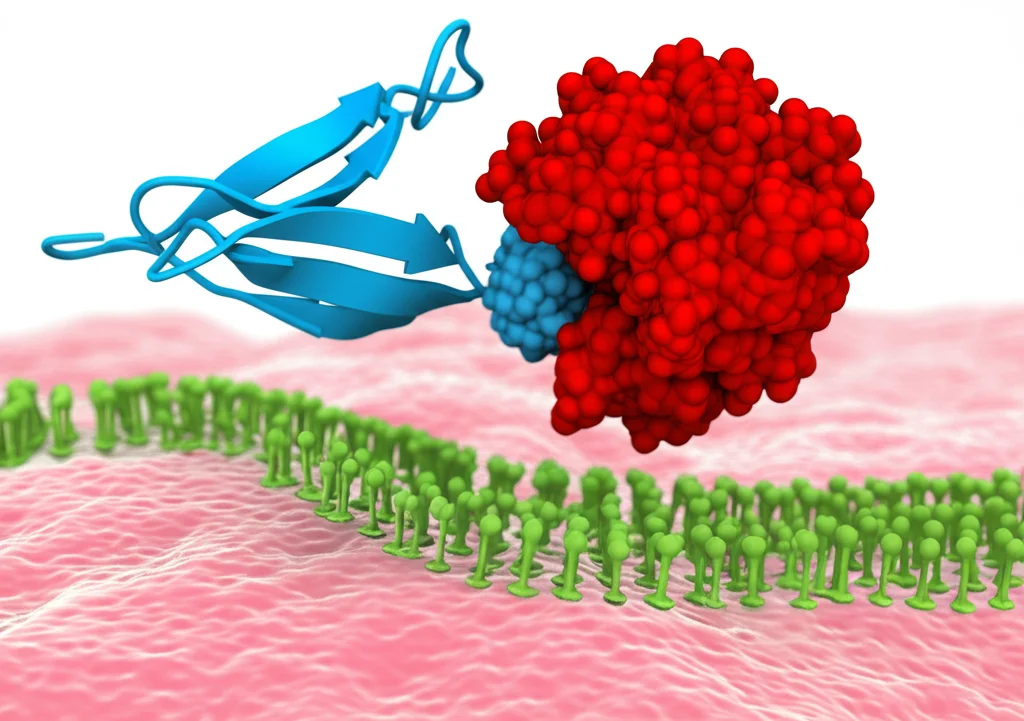
Focus su PD-L1: Un Bersaglio Cruciale nell’Immunoterapia
Prendiamo ad esempio PD-L1, uno dei checkpoint immunitari più studiati. Quando PD-L1 sulla cellula tumorale si lega al suo recettore PD-1 sui linfociti T (i nostri soldati immunitari), dice loro: “Alt! Fermatevi, non attaccate”. La N-glicosilazione di PD-L1 è fondamentale per questo legame “spegni-difese”.
Cosa fa il nostro DGlyTAC specifico per PD-L1 (nbhPDL1-PNGF per la versione umana, nbmPDL1-PNGF per quella murina)? Va lì, si lega a PD-L1 e gli toglie gli N-glicani. Risultato? PD-L1 non riesce più a legarsi efficacemente a PD-1. L’interazione è disturbata in modo significativo e, cosa importantissima, irreversibile! A differenza degli inibitori classici che bloccano temporaneamente il legame finché sono presenti, DGlyTAC modifica la proteina bersaglio in modo permanente (finché la cellula non ne produce di nuova).
Un’altra cosa interessante: abbiamo visto che rimuovere gli N-glicani da PD-L1 non sembra renderla instabile o degradarla più velocemente sulla membrana cellulare. Semplicemente, la disarma. Questo, unito al fatto che DGlyTAC agisce in modo catalitico (una molecola di DGlyTAC può disarmare molte molecole di PD-L1, un po’ come un operaio che smonta tante macchine), significa che potremmo ottenere effetti terapeutici potenti e duraturi anche a concentrazioni più basse rispetto agli inibitori tradizionali.
Successo in Laboratorio… e Oltre! Risultati Promettenti
Ovviamente, non ci siamo fermati alle provette. Abbiamo testato i nostri DGlyTAC, in particolare quello contro PD-L1 (nbmPDL1-PNGF), in modelli animali di cancro (topi con tumori al seno triplo negativo come E0771 e 4T1, e tumori del colon come MC38). I risultati sono stati davvero incoraggianti!
- Il trattamento con nbmPDL1-PNGF ha rallentato significativamente la crescita tumorale.
- Abbiamo osservato un aumento delle cellule immunitarie T “killer” (CD8+) all’interno del tumore, segno che il sistema immunitario si era risvegliato.
- In alcuni esperimenti, l’efficacia del nostro DGlyTAC è stata paragonabile o addirittura superiore a quella degli anticorpi anti-PD-1 (abPD-1) o anti-PD-L1 (abPD-L1) usati clinicamente!
- Anche la sopravvivenza degli animali trattati è migliorata.
Questi dati suggeriscono che DGlyTAC ha un potenziale terapeutico reale.

E la Sicurezza? Un Punto Chiave
Una delle grandi sfide con le terapie antitumorali è la tossicità. Gli inibitori dei checkpoint, agendo a livello sistemico, possono a volte causare effetti collaterali autoimmuni perché “sbloccano” il sistema immunitario anche contro tessuti sani. Ci siamo chiesti: come si comporta DGlyTAC?
Abbiamo studiato dove va a finire il nostro nbmPDL1-PNGF nel corpo dei topi (biodistribuzione) e quali effetti ha sugli organi sani. Abbiamo visto che, sebbene la molecola si distribuisca in organi come fegato, polmoni e reni (dove PD-L1 può essere espresso), l’effetto di deglicosilazione (la rimozione degli zuccheri) era massimo e quasi completo nel tumore, e molto limitato negli altri organi, specialmente fegato e reni. Solo nel polmone abbiamo visto un po’ di deglicosilazione.
Inoltre, le analisi istologiche (HeE) e di morte cellulare (TUNEL) su cuore, fegato, milza, polmoni e reni non hanno mostrato segni significativi di tossicità, così come i parametri del sangue erano normali. Questo suggerisce che DGlyTAC potrebbe avere un profilo di sicurezza migliore rispetto agli anticorpi tradizionali, grazie alla sua azione più mirata a livello funzionale (deglicosila dove serve di più, cioè nel tumore ad alta espressione di PD-L1).
DGlyTAC vs. Gli Altri: Cosa Cambia?
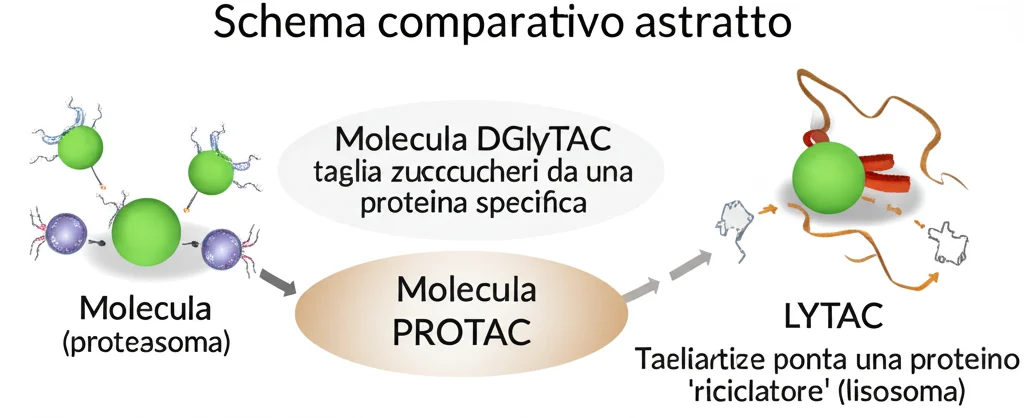
Forse avrete sentito parlare di altre tecnologie “chimera” come i PROTAC (che marcano le proteine per la distruzione da parte del proteasoma cellulare) o i LYTAC (che le indirizzano ai lisosomi per la degradazione). DGlyTAC condivide l’idea di usare una molecola bifunzionale per agire su un bersaglio, ma il meccanismo è diverso:
- Non dipende dai macchinari di degradazione della cellula (come E3 ligasi per PROTAC o recettori lisosomiali per LYTAC), il che potrebbe renderlo applicabile a più tipi cellulari.
- Agisce sulla superficie cellulare, senza necessariamente dover entrare nella cellula (anche se la permeabilità può essere un vantaggio).
- Inattiva la proteina modificandola (togliendo N-glicani), non distruggendola.
- È rapido (abbiamo visto effetti in 2 ore) e potenzialmente duraturo (l’effetto persiste anche dopo che DGlyTAC è stato rimosso).
- È catalitico e riciclabile, permettendo efficacia a basse dosi.
Esistono anche coniugati anticorpo-sialidasi (sviluppati da Carolyn Bertozzi), che rimuovono l’acido sialico (un tipo di zucchero terminale) dalle cellule. Ma DGlyTAC è diverso: bersaglia specificamente gli N-glicani di una *proteina* specifica, non gli zuccheri in generale su una *cellula*. Questo permette una precisione ancora maggiore.
Uno Sguardo al Futuro: Potenzialità e Sfide
Siamo davvero entusiasti del potenziale di DGlyTAC. È una piattaforma versatile: cambiando il “GPS” (il nanocorpo o affibody), possiamo in teoria indirizzare le nostre forbici molecolari contro quasi qualsiasi proteina di superficie N-glicosilata.
Questo apre strade non solo per l’immunoterapia oncologica, ma anche per studiare la funzione fondamentale della N-glicosilazione in tantissimi processi biologici. Prima di portare DGlyTAC in clinica, è cruciale capire bene quali N-glicosilazioni sono davvero importanti per la funzione di una proteina bersaglio. Ma la cosa bella è che DGlyTAC stesso può essere usato come strumento di ricerca per scoprirlo!
Certo, come per gli anticorpi, la sfida sarà gestire la potenziale tossicità se la proteina bersaglio è espressa anche su tessuti sani. Ma la specificità funzionale della deglicosilazione potrebbe offrire un vantaggio.
In conclusione, DGlyTAC rappresenta un nuovo modo, elegante e potente, per disarmare le proteine nemiche agendo sulla loro “armatura” di zuccheri. È una strategia che combina la specificità del targeting anticorpale con l’efficienza catalitica di un enzima, aprendo nuove prospettive per la ricerca e, speriamo presto, per terapie più efficaci e sicure contro il cancro e altre malattie. La strada è ancora lunga, ma i primi passi sono decisamente promettenti!
Fonte: Springer