Cancro Cervicale: E se la Chiave per Sconfiggerlo Fosse Riaccendere un Gene Silenziato?
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi ha davvero affascinato nel campo della ricerca sul cancro, in particolare quello cervicale. Immaginate di avere un interruttore molecolare che, se spento, favorisce la crescita di un tumore, ma se riacceso, può fermarlo e persino renderlo più vulnerabile alle terapie. Sembra fantascienza, vero? Eppure, è proprio quello che sembra succedere con un gene chiamato EphA7 nel cancro della cervice uterina.
Il “silenzio” di un gene chiave: EphA7 nel cancro cervicale
Il cancro cervicale, purtroppo, è ancora una minaccia seria per la salute delle donne in tutto il mondo. Nonostante i progressi nelle cure, ci sono ancora troppi casi di resistenza ai farmaci, recidive e metastasi. Ecco perché la ricerca di nuove strategie terapeutiche è fondamentale.
Da tempo si sospettava che il gene EphA7 avesse un ruolo in questo tipo di tumore. In particolare, si era notato che il suo “promotore” – la regione del DNA che ne regola l’accensione – era spesso “ipermetilato”. Cosa significa? In parole povere, è come se delle piccole etichette chimiche (gruppi metilici) si attaccassero al promotore, spegnendo di fatto il gene. Questo processo si chiama metilazione ed è un meccanismo epigenetico, cioè una modifica che non cambia la sequenza del DNA ma ne altera la funzione. Nel nostro caso, questa ipermetilazione silenzia EphA7, e questo sembra essere un bel problema.
Ma quale fosse il ruolo preciso di EphA7 e della sua metilazione nel cancro cervicale era ancora un mistero. Fino ad ora.
CRISPR: La bacchetta magica che riaccende EphA7
Qui entra in gioco la tecnologia che sta rivoluzionando la biologia: CRISPR. Nello studio che sto per raccontarvi, i ricercatori hanno usato uno strumento basato su CRISPR, chiamato dCas9-Tet1, progettato specificamente per *rimuovere* quelle etichette di metilazione dal promotore di EphA7. In pratica, hanno cercato di riaccendere l’interruttore!
E i risultati sono stati pazzeschi. Utilizzando questo strumento su cellule di cancro cervicale in laboratorio (le linee CaSki e SiHa), hanno visto che la riattivazione di EphA7 aveva effetti antitumorali potentissimi:
- Frenava la proliferazione delle cellule tumorali.
- Limitava la loro capacità di invadere i tessuti circostanti.
- Promuoveva l’apoptosi, cioè il suicidio programmato delle cellule cancerose.
Insomma, riaccendere EphA7 sembrava mettere i bastoni tra le ruote al tumore su più fronti.
Come fa EphA7 a fermare il tumore? La via PI3K/AKT
Ok, ma qual è il meccanismo d’azione? Come fa EphA7 a fare tutto questo? Analizzando le cellule, si è scoperto che la riattivazione di EphA7 va a interferire con una via di segnalazione cellulare importantissima, chiamata PI3K/AKT. Questa via è come un’autostrada per la crescita e la sopravvivenza delle cellule tumorali; è spesso iperattiva nei tumori, compreso quello cervicale. Bloccando o rallentando questa via, EphA7 riesce a esercitare i suoi effetti antitumorali. È come se chiudesse un rubinetto che alimenta la crescita del cancro.
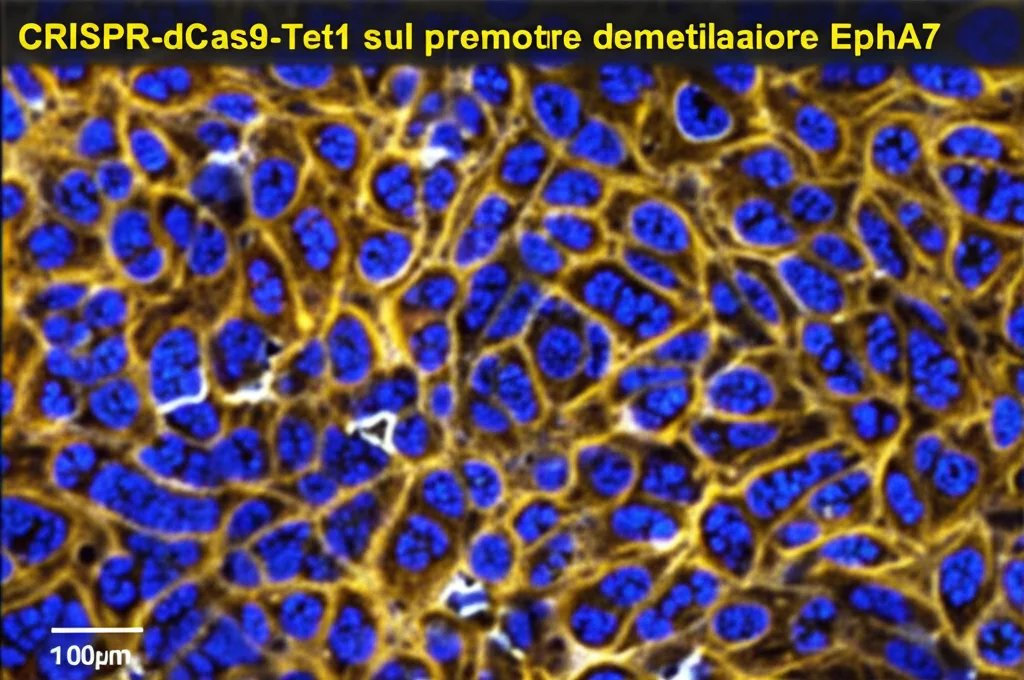
Chi spegne l’interruttore? Il ruolo di SP1 e DNMT1
Ma chi è il responsabile di questo “spegnimento” iniziale di EphA7 tramite metilazione? I ricercatori hanno usato un’altra tecnica ingegnosa, sempre basata su CRISPR, per “pescare” le proteine che si legano direttamente al promotore di EphA7. Hanno così identificato due principali sospettati: SP1 e MAZ.
Facendo ulteriori esperimenti, però, hanno capito che il vero colpevole era SP1. Questa proteina, infatti, sembra reclutare un enzima chiamato DNMT1, che è proprio quello che attacca le etichette di metilazione al DNA. Quindi, la catena degli eventi sembra essere: SP1 si lega al promotore di EphA7, chiama a raccolta DNMT1, e quest’ultimo silenzia il gene. MAZ, invece, non sembrava coinvolto in questo specifico processo.
Un aiuto inaspettato: l’Estrogeno
E qui arriva una sorpresa. Analizzando le vie di segnalazione alterate da EphA7, è spuntata anche quella degli estrogeni. Approfondendo, si è scoperto che il trattamento delle cellule tumorali con estradiolo (E2, la forma più comune di estrogeno) portava a una *diminuzione* dei livelli di SP1. Di conseguenza, c’era meno reclutamento di DNMT1, il promotore di EphA7 veniva *demetilato* e il gene si riattivava!
Questo suggerisce un legame complesso tra ormoni, epigenetica e cancro cervicale. Sembra che l’estrogeno, in questo contesto, possa avere un effetto protettivo indiretto, aiutando a mantenere attivo il gene oncosoppressore EphA7 contrastando l’azione di SP1. È un risultato intrigante che merita ulteriori studi, considerando il ruolo complesso degli estrogeni nei tumori femminili.
Rendere le terapie più efficaci: la chemiosensibilità
Forse uno degli aspetti più promettenti di questa ricerca riguarda le terapie esistenti. Sappiamo che la chemioterapia, con farmaci come il cisplatino e il paclitaxel, è uno standard di cura per il cancro cervicale, ma spesso insorge resistenza. Ebbene, lo studio ha dimostrato che la demetilazione di EphA7 (ottenuta con CRISPR) rendeva le cellule tumorali *significativamente più sensibili* a questi farmaci!
In pratica, riattivare EphA7 non solo combatte il tumore direttamente, ma abbassa anche le sue difese contro la chemioterapia. La concentrazione di farmaco necessaria per uccidere le cellule (la cosiddetta IC50) si riduceva notevolmente. Questo apre la porta a possibili terapie combinate: usare la demetilazione mirata di EphA7 per potenziare l’effetto della chemio.

Un’arma in più per l’immunoterapia?
Ma non è finita qui. La ricerca ha esplorato anche il legame tra EphA7 e la risposta immunitaria contro il tumore. Analizzando dati da grandi database (come TCGA), è emerso un quadro molto interessante:
- L’ipermetilazione di EphA7 era associata a una maggiore “purezza tumorale” (più cellule tumorali e meno cellule immunitarie nel campione, generalmente un segno negativo) e a una minore infiltrazione di cellule immunitarie “buone” (come i linfociti T citotossici, CTL, che uccidono le cellule tumorali).
- Al contrario, la demetilazione (ipometilazione) e l’alta espressione di EphA7 erano correlate a una maggiore attività dei CTL e a livelli più alti di espressione dei cosiddetti “checkpoint immunitari” (IC, come PD-L1, CTLA4). Questi sono i bersagli delle moderne immunoterapie (ICB).
- Inoltre, l’alta espressione di EphA7 era associata a un maggior carico mutazionale del tumore (TMB), instabilità dei microsatelliti (MSI) e presenza di neoantigeni – tutti fattori che possono predire una migliore risposta all’immunoterapia.
Cosa significa tutto questo? Che i tumori con EphA7 attivo (demetilato) potrebbero essere più “visibili” e vulnerabili al sistema immunitario e rispondere meglio alle immunoterapie, come quelle anti-PD-L1. Addirittura, i dati suggeriscono che i pazienti con alta espressione di EphA7 trattati con anti-PD-L1 avevano una prognosi migliore.
Conclusioni: Una nuova speranza per il cancro cervicale
Tirando le somme, questa ricerca ci dice che EphA7 agisce come un vero e proprio soppressore tumorale nel cancro cervicale. Il suo silenziamento tramite metilazione (guidato da SP1/DNMT1) favorisce la crescita e l’invasione tumorale attraverso la via PI3K/AKT.
La cosa entusiasmante è che questo processo è reversibile! La demetilazione mirata del promotore di EphA7, ottenibile con strumenti come CRISPR-dCas9-Tet1, non solo inibisce direttamente il tumore, ma lo rende anche più sensibile alla chemioterapia e potenzialmente all’immunoterapia.
EphA7 emerge quindi come un bersaglio terapeutico incredibilmente promettente e un potenziale marcatore per predire la prognosi e la risposta alle cure nel cancro cervicale. Certo, siamo ancora a livello di ricerca preclinica, e sfide come il “delivery” sicuro ed efficace di questi strumenti CRISPR alle cellule tumorali nel corpo umano devono essere affrontate. Ma la strada è tracciata, e ci offre una nuova, potente speranza nella lotta contro questa malattia. È davvero affascinante vedere come la comprensione profonda dei meccanismi molecolari possa aprire orizzonti terapeutici impensabili fino a poco tempo fa!
Fonte: Springer