Fegato danneggiato? Degradare i detriti è la chiave del recupero, non smontarli!
Ragazzi, parliamo di un organo incredibile: il nostro fegato. Un vero guerriero che lavora sodo ogni giorno, ma che a volte può subire dei colpi duri, come nel caso di un danno acuto, magari indotto da farmaci (il paracetamolo in dosi eccessive è un classico esempio studiato). Quando le cellule del fegato muoiono in modo “disordinato” – un processo chiamato necrosi – lasciano dietro di sé un bel pasticcio: i cosiddetti detriti necrotici.
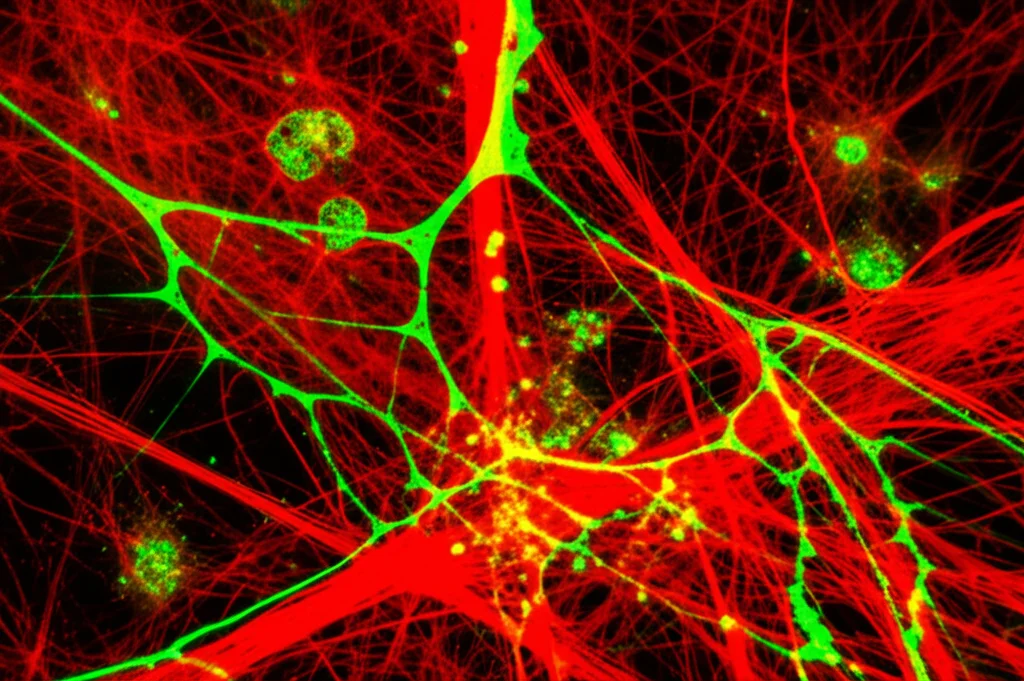
Pensate a questi detriti come alle macerie dopo un crollo: pezzi di cellule rotte, DNA sparso ovunque, filamenti proteici come l’actina, istoni (le proteine che impacchettano il DNA) e altre molecole che normalmente dovrebbero stare ben chiuse dentro le cellule. Questi detriti non sono solo spazzatura innocua; anzi, scatenano una forte infiammazione perché il nostro sistema immunitario li riconosce come segnali di pericolo (li chiamiamo DAMPs, Damage-Associated Molecular Patterns). Un po’ di infiammazione serve per iniziare la riparazione, ma se i detriti restano lì troppo a lungo, l’infiammazione diventa eccessiva e può fare più danni che altro, ostacolando il recupero del tessuto.
Quindi, la domanda cruciale è: qual è il modo migliore per ripulire queste macerie e aiutare il fegato a guarire? È meglio “degradare” i detriti, cioè romperli in pezzi piccolissimi, o magari basta “smontarli”, separando i vari componenti?
Ma cosa c’è davvero in questi detriti?
Prima di capire come pulire, dovevamo vedere bene cosa c’era da pulire! Usando tecniche pazzesche come la microscopia intravitale (che ci permette di guardare dentro il fegato di un topolino vivo, in tempo reale!) e la microproteomica spazialmente risolta (che analizza le proteine presenti in aree piccolissime del tessuto), abbiamo scoperto che questi detriti necrotici sono un mix molto più complesso di quanto pensassimo.
C’è un sacco di DNA extracellulare, ovviamente, ma anche tantissima F-actina (la forma filamentosa dell’actina, una proteina del citoscheletro). E poi istoni, componenti del sistema del complemento (come il C3), fibrinogeno/fibrina (le proteine della coagulazione) e plasminogeno/plasmina (coinvolti nello scioglimento dei coaguli). Insomma, un vero e proprio groviglio molecolare!
Una cosa interessante che abbiamo notato con la microscopia intravitale è che, anche se le cellule erano morte e la loro membrana rotta, i filamenti di F-actina all’interno sembravano rimanere abbastanza intatti. Questo potrebbe essere importante, perché forse è proprio la forma filamentosa dell’actina ad essere riconosciuta come segnale di pericolo.

Strategia 1: Degradare il DNA con DNase 1
La prima idea che abbiamo testato è stata quella di usare un enzima chiamato DNase 1. Questo enzima è specializzato nel tagliare il DNA. L’ipotesi era: se rompiamo il DNA, che magari fa da “impalcatura” per gli altri detriti, forse facilitiamo la pulizia generale e riduciamo l’infiammazione.
Abbiamo trattato i topolini con danno epatico da paracetamolo con iniezioni di DNase 1. E i risultati? Davvero incoraggianti! I livelli degli enzimi epatici nel sangue (come l’ALT, un marcatore di danno) erano significativamente più bassi nei topi trattati con DNase 1 dopo 48 ore. Anche la deposizione di fibrina nel fegato era ridotta, segno di un miglior recupero. Inoltre, abbiamo visto che il trattamento con DNase 1 riduceva i livelli circolanti di nucleosomi (frammenti di DNA avvolto attorno agli istoni) e di actina. Sembrava proprio che degradare il DNA aiutasse a “smaltire” anche altri componenti pericolosi che finiscono nel sangue.
C’è un “ma”, però. Guardando direttamente nelle aree necrotiche con la microscopia intravitale, abbiamo visto che mentre la DNase 1 riduceva effettivamente il segnale del DNA, non sembrava avere un grande impatto sulla quantità di F-actina presente localmente in quelle aree. Quindi, il DNA non sembra fare da impalcatura diretta per l’actina nei detriti. L’effetto benefico della DNase 1 sembra più legato alla riduzione del carico di DNA e alla migliore eliminazione dei DAMPs circolanti.
Strategia 2: Smontare i detriti con peptidi speciali
Ok, se degradare il DNA funziona ma non smuove tutto, forse basta “allentare” i legami tra i vari componenti dei detriti? Sappiamo che ci sono interazioni basate sulle cariche elettriche: il DNA e l’actina sono carichi negativamente, mentre gli istoni sono carichi positivamente. Magari si “incollano” tra loro formando complessi stabili e difficili da degradare.
Abbiamo quindi provato a usare dei piccoli peptidi sintetici (brevi catene di amminoacidi) carichi positivamente (PLK, poli-L-lisina) o negativamente (PLE, poli-L-glutammato). L’idea era che questi peptidi potessero “spostare” gli istoni, rompendo i complessi. In vitro (cioè in provetta, usando detriti di cellule epatiche umane), sia PLK che PLE si sono dimostrati capaci di staccare gli istoni dai detriti. Sembrava promettente!

Ma ahimè, quando abbiamo testato questi peptidi nei nostri topolini con danno epatico, non abbiamo visto alcun miglioramento. Né i livelli di ALT né altri parametri di danno o recupero sono cambiati. Sembra quindi che il semplice “smontaggio” dei detriti, almeno rompendo i legami con gli istoni, non sia sufficiente per migliorare la situazione in vivo. Forse c’è qualcos’altro che tiene insieme tutto quanto?
Strategia 3: Rompere l’involucro di fibrina con tPa
Un altro attore importante sulla scena del crimine è la fibrina. Questa proteina forma una rete, un coagulo, che normalmente serve a fermare le emorragie, ma che in caso di danno tissutale può anche “incapsulare” le aree necrotiche. Ci siamo chiesti: e se questa capsula di fibrina, invece di aiutare, stesse intrappolando i detriti e impedendone la rimozione?
Per testare questa ipotesi, abbiamo usato l’attivatore tissutale del plasminogeno (tPa), una molecola che attiva la plasmina, l’enzima principale che scioglie la fibrina (un processo chiamato fibrinolisi). L’idea era: sciogliamo la fibrina, liberiamo i detriti e vediamo se il recupero migliora.
Risultato? Esattamente l’opposto di quello sperato! I topi trattati con tPa stavano peggio. Abbiamo osservato aree di necrosi e deposizione di fibrina più estese nel fegato e, cosa importante, un aumento dei livelli di actina nel sangue. Sembra che rompere l’involucro di fibrina troppo presto non faccia altro che liberare più DAMPs in circolo, peggiorando l’infiammazione e il danno. Anche trattare i topi con eparina (un anticoagulante) o iniettare direttamente actina nel sangue dopo il danno ha peggiorato la situazione, confermando che la “dispersione” incontrollata dei detriti è dannosa.
Quindi, quella capsula di fibrina sembra avere un ruolo protettivo, almeno nelle fasi iniziali, contenendo il danno e i detriti.
La morale della favola: Degradare è meglio che smontare!
Mettendo insieme tutti i pezzi, cosa abbiamo imparato da questa avventura scientifica? Che la gestione dei detriti necrotici dopo un danno epatico acuto è una faccenda complessa.
- I detriti sono un mix intricato di DNA, actina, istoni, fibrina e altro.
- Degradare specifici componenti chiave, come il DNA con la DNase 1, è una strategia efficace per migliorare il recupero, probabilmente riducendo il carico di DAMPs circolanti e l’infiammazione sistemica.
- Il semplice smontaggio dei complessi di detriti (almeno tramite peptidi che spostano gli istoni) non sembra sufficiente in vivo.
- Rompere prematuramente l’incapsulamento di fibrina che contiene i detriti è addirittura dannoso.
In conclusione, sembra proprio che per favorire la guarigione del fegato, la strategia vincente sia quella di promuovere attivamente la degradazione enzimatica dei detriti necrotici, piuttosto che cercare semplicemente di smontarli o di rompere le barriere naturali che li contengono. Questo ci dà indicazioni preziose per pensare a future terapie mirate a facilitare la “pulizia” dopo un danno epatico acuto.
Fonte: Springer