Decifrando KKT23: Uno Sguardo Intimo nel Cuore dei Cromosomi del Trypanosoma
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico, alla scoperta di meccanismi cellulari fondamentali e di organismi un po’… particolari. Parleremo di come le cellule si dividono e distribuiscono il loro preziosissimo materiale genetico, un processo vitale che, se va storto, può portare a guai seri come il cancro. Al centro di tutto c’è una struttura incredibile chiamata cinetocore.
Il Cinetocore: Un Regista Molecolare Essenziale
Immaginate il cinetocore come un complesso macchinario proteico che fa da ponte tra il DNA dei cromosomi e i “cavi” (i microtubuli del fuso mitotico) che li tireranno ai poli opposti della cellula durante la divisione. Molti dei componenti di questo macchinario sono super conservati tra le varie specie, dagli lieviti agli umani. Parliamo di proteine come CENP-A e Ndc80, vere superstar del mondo eucariotico.
L’Enigma dei Cinetoplastidi: Trypanosoma e Co.
Ma ecco che arriva il bello: c’è un gruppo di organismi, i cinetoplastidi (pensate a parassiti come il Trypanosoma brucei, che causa la malattia del sonno, o il Trypanosoma cruzi e la Leishmania), che sembrano fare le cose a modo loro. Nei loro genomi, le proteine “classiche” del cinetocore sono introvabili! Sembra incredibile, vero? Invece, questi organismi hanno sviluppato un set completamente unico di oltre 30 proteine, chiamate KKT (Kinetoplastid Kinetochore Proteins), che svolgono lo stesso lavoro ma con “pezzi” diversi. È come se avessero costruito la stessa macchina usando un progetto totalmente differente. Capire come funzionano questi cinetocori “alternativi” è fondamentale, non solo per la biologia di base, ma anche perché potrebbero offrirci nuovi bersagli per combattere le malattie che questi parassiti causano.
KKT23: Una Proteina Chiave con un Lavoro Speciale
Nel nostro laboratorio, ci siamo concentrati su una di queste proteine uniche: la KKT23. Studiando questa proteina, abbiamo fatto una scoperta intrigante. Abbiamo visto, usando tecniche come la cristallografia a raggi X e la spettroscopia NMR (di cui parleremo tra poco), che KKT23 possiede una regione specifica, un dominio, che assomiglia strutturalmente a una famiglia di enzimi noti come acetiltransferasi (in particolare, simile a GCN5). E non è solo una somiglianza estetica! Abbiamo dimostrato che KKT23 è effettivamente in grado di “acetilare”, cioè attaccare un piccolo gruppo chimico (acetile), a una specifica proteina che impacchetta il DNA, l’istone H2A, proprio all’interno dei nucleosomi del Trypanosoma brucei. Questo processo di acetilazione è spesso un modo per regolare l’attività dei geni o la struttura della cromatina. Quindi, KKT23 non è solo parte del cinetocore, ma svolge anche un ruolo enzimatico potenzialmente cruciale.
Entra in Scena l’NMR: Vedere le Molecole in Azione
Per capire davvero come funziona KKT23, come interagisce con altre molecole e come svolge il suo lavoro di acetiltransferasi, avevamo bisogno di uno strumento che ci permettesse di “vederla” in dettaglio, non solo come una foto statica (come nella cristallografia), ma anche in soluzione, più vicina al suo ambiente naturale, e potenzialmente mentre si muove e interagisce. Qui entra in gioco la Spettroscopia di Risonanza Magnetica Nucleare (NMR). È una tecnica potentissima che sfrutta le proprietà magnetiche dei nuclei atomici (come quelli di idrogeno 1H, carbonio 13C e azoto 15N) per ottenere informazioni incredibilmente dettagliate sulla struttura tridimensionale, sulla dinamica e sulle interazioni delle molecole.
Pensate all’NMR come a un modo per dare “un nome e cognome” a quasi ogni atomo della proteina. Ogni atomo, a seconda del suo ambiente chimico all’interno della proteina, produrrà un segnale specifico (una “risonanza”) nello spettro NMR. Il primo passo fondamentale per usare l’NMR per studiare una proteina è proprio questo: assegnare ogni segnale all’atomo specifico che lo genera. È un lavoro certosino, un po’ come risolvere un puzzle tridimensionale complicatissimo.
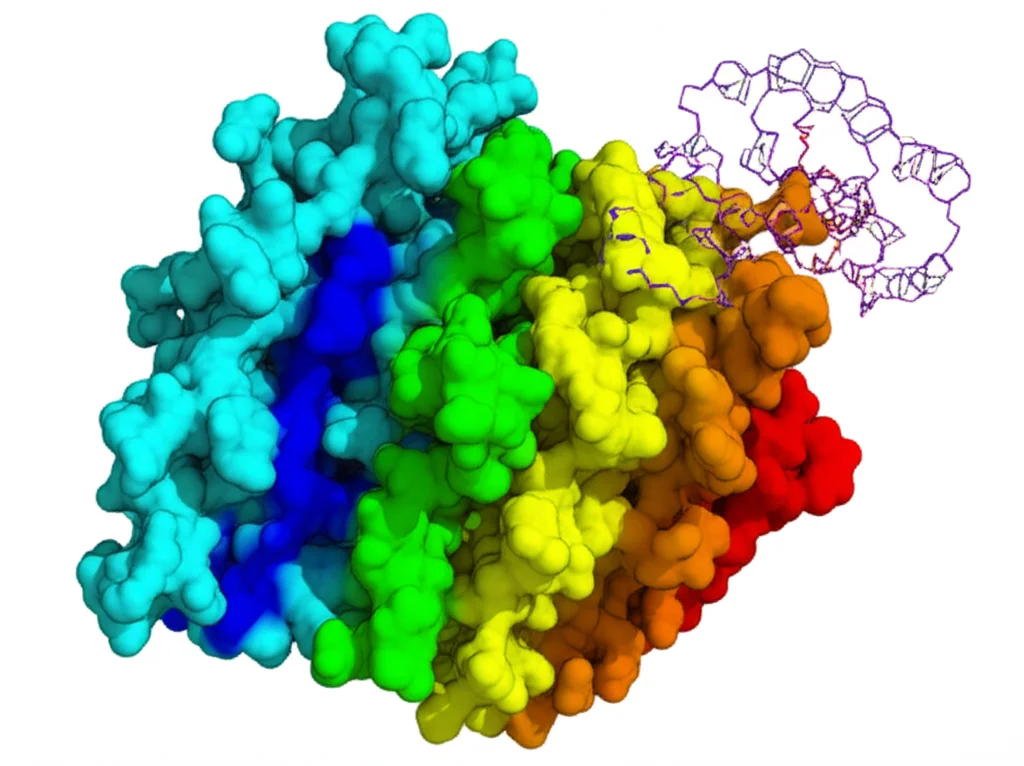
Il Nostro Lavoro: La Mappa di KKT23
Ed è proprio questo che abbiamo fatto e che vi racconto oggi! Abbiamo prodotto la parte di KKT23 contenente il dominio acetiltransferasi (chiamata KKT23125–348) in batteri, marcandola con isotopi specifici (13C e 15N) per renderla “visibile” all’NMR. Poi, abbiamo usato una serie di esperimenti NMR sofisticati (2D e 3D) per ottenere e, finalmente, assegnare le risonanze 1H, 13C e 15N per questa proteina.
Non l’abbiamo fatto sulla proteina isolata, che si è rivelata un po’ instabile, ma l’abbiamo studiata mentre era legata ai suoi “partner” naturali: l’acetil-coenzima A (acetil-CoA), che è la molecola che fornisce il gruppo acetile da trasferire, e il coenzima A (CoA), ciò che rimane dopo che il gruppo acetile è stato donato. Studiarla in questi complessi è molto più significativo dal punto di vista funzionale.
Cosa Abbiamo Imparato (e Cosa Potremo Imparare)
Siamo riusciti ad assegnare la stragrande maggioranza dei segnali NMR per la KKT23125–348 legata sia all’acetil-CoA che al CoA. Questo è un risultato importantissimo! Queste assegnazioni sono come una mappa dettagliatissima della proteina in soluzione.
Abbiamo anche misurato delle cose chiamate accoppiamenti dipolari residuali (RDC). Senza entrare troppo nel tecnico, gli RDC ci danno informazioni sull’orientamento di specifiche parti della proteina rispetto a un campo magnetico esterno. Confrontando i nostri RDC sperimentali con quelli calcolati a partire dalla struttura ottenuta ai raggi X, abbiamo visto una buona corrispondenza generale. Questo ci dice che la struttura della proteina in soluzione è molto simile a quella nel cristallo, anche se ci sono piccole differenze, specialmente in alcune regioni più flessibili (loop) che nell’NMR appaiono mobili.
Confrontando gli spettri della proteina legata all’acetil-CoA con quelli della proteina legata al CoA (senza il gruppo acetile), abbiamo notato piccole ma significative differenze nei segnali di alcuni amminoacidi. Questi “spostamenti chimici” si concentrano proprio vicino a dove si lega il gruppo acetile. È logico: togliere quel pezzetto cambia leggermente l’ambiente chimico circostante e la proteina “lo sente”. Questo ci dà indizi su come la proteina interagisce con i suoi cofattori durante il ciclo catalitico.
Un Punto di Partenza per il Futuro
Queste assegnazioni di risonanza, che abbiamo depositato in una banca dati pubblica (BioMagResBank) affinché tutta la comunità scientifica possa usarle, sono davvero il punto di partenza per studi molto più approfonditi. Ora che abbiamo la “mappa”, possiamo iniziare a:
- Studiare la dinamica della proteina: come si muove? Quali parti sono rigide e quali flessibili? Questo è cruciale per capire la sua funzione.
- Mappare con precisione i siti di interazione con altre molecole: come lega l’istone H2A? Interagisce con altre proteine del cinetocore?
- Investigare i cambiamenti conformazionali che avvengono durante la reazione enzimatica.
- Potenzialmente, usare queste informazioni per disegnare farmaci che possano bloccare l’attività di KKT23, offrendo nuove strategie contro le malattie causate dai tripanosomi.
Insomma, aver decifrato la “carta d’identità” NMR di KKT23 ci apre un mondo di possibilità per capire meglio la biologia unica di questi parassiti e, speriamo, per trovare nuovi modi per combatterli. È un piccolo passo nel grande schema delle cose, ma fondamentale per andare avanti!
Fonte: Springer