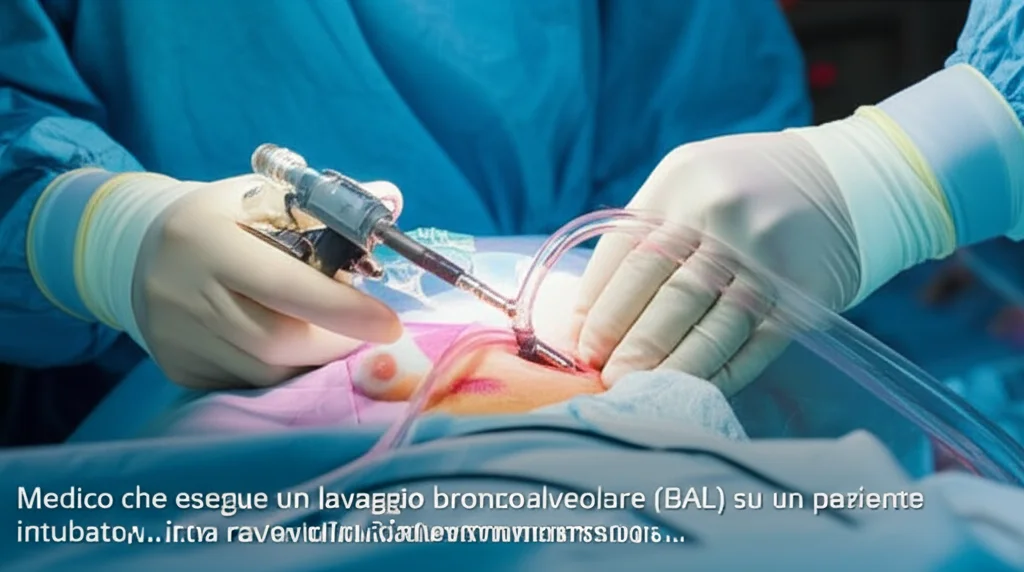
Polmonite in Terapia Intensiva: Meno Antibiotici, Stessi Risultati? La Rivoluzione del Lavaggio Broncoalveolare
Ragazzi, parliamoci chiaro: la polmonite nei pazienti critici, quelli ricoverati in terapia intensiva, è una delle sfide più grandi che affrontiamo in ospedale. È una delle principali cause di malattia e, purtroppo, di mortalità a livello globale. E quando si parla di polmonite, si parla quasi sempre di antibiotici. Sono armi fondamentali, certo, ma usarle nel modo giusto è un’arte complessa, soprattutto oggi, con il fantasma sempre più concreto dell’antibiotico-resistenza che incombe.
La Sfida: Capire Cosa Succede Davvero nei Polmoni
Il punto cruciale è proprio questo: gestire gli antibiotici con saggezza (quella che chiamiamo antibiotic stewardship) è fondamentale, ma terribilmente difficile in terapia intensiva. Perché? Beh, in parte perché i test diagnostici “classici”, quelli non invasivi, spesso non ci danno un quadro chiarissimo. Prendiamo i campioni di espettorato (il catarro, per intenderci) o gli aspirati tracheali: non sempre si riescono ad ottenere campioni di buona qualità, e anche quando ci si riesce, i risultati possono essere lenti ad arrivare o poco affidabili. L’esame al microscopio (Gram stain) è rapido, ma non sempre “becca” il batterio giusto. Le colture richiedono giorni per identificare il germe e testare la sua sensibilità agli antibiotici. E le emocolture (l’analisi del sangue)? Spesso risultano negative, anche in casi di polmonite grave.
Insomma, ci troviamo spesso in una situazione di incertezza. E cosa fa un medico in terapia intensiva quando è incerto ma ha davanti un paziente grave? Tende a usare antibiotici a largo spettro, quelli che coprono tanti batteri diversi, per non rischiare. Comprensibile, ma questo alimenta il circolo vizioso della resistenza. Le linee guida ci dicono di “scalare” la terapia (de-escalation), cioè passare ad antibiotici più mirati o addirittura sospenderli se non ci sono prove di infezioni batteriche resistenti o se i test sono negativi. Ma la realtà è che c’è molta esitazione a farlo, per paura di peggiorare le condizioni del paziente.
Una Nuova Strategia: Ascoltare Direttamente i Polmoni con il BAL
E se potessimo avere informazioni più precise e più rapide direttamente dalla fonte dell’infezione, cioè dai polmoni? Qui entra in gioco il lavaggio broncoalveolare (BAL). Si tratta di una procedura più invasiva, è vero, ma che ci permette di prelevare campioni direttamente dalle basse vie respiratorie. Questo campione è preziosissimo perché può essere analizzato in tanti modi: conta delle cellule infiammatorie, colture quantitative (che ci dicono *quanti* batteri ci sono, non solo quali) e, soprattutto, test molecolari rapidi (multiplex PCR).
Questi test PCR sono una vera svolta: in poche ore possono identificare un pannello di batteri e virus comuni, e persino alcuni geni di resistenza agli antibiotici. Immaginate il potenziale: avere un’idea chiara dell’eventuale nemico (batterio? virus? entrambi? nessuno?) e delle sue “armi” (resistenze?) in tempi rapidissimi.
Nel nostro centro, abbiamo deciso di esplorare a fondo questa strategia. Abbiamo condotto uno studio prospettico (lo studio SCRIPT) su pazienti ricoverati nella nostra terapia intensiva medica, ventilati meccanicamente e con sospetta polmonite, che venivano sottoposti a BAL. Abbiamo combinato i risultati delle colture quantitative con quelli dei test PCR rapidi per guidare le nostre decisioni sulla terapia antibiotica.

Misurare la De-escalation: Il Punteggio NAT
Per capire se e come stavamo cambiando l’approccio agli antibiotici giorno per giorno, abbiamo usato uno strumento chiamato NAT score (Narrow Antibiotic Therapy score). È un punteggio che quantifica non solo se un antibiotico viene dato, ma anche quanto è “ampio” il suo spettro d’azione. Un punteggio basso significa terapia mirata o assente, un punteggio alto significa terapia ad ampio spettro. L’idea era tracciare l’andamento di questo punteggio nei giorni successivi al BAL per vedere se, grazie alle informazioni ottenute, riuscivamo effettivamente a “scalare” la terapia.
Abbiamo analizzato quasi mille episodi di sospetta polmonite in quasi 700 pazienti. Dopo un’attenta revisione di tutti i dati clinici e dei risultati del BAL, abbiamo classificato ogni episodio come:
- Polmonite batterica (ulteriormente divisa in sensibile o resistente agli antibiotici)
- Polmonite virale
- Polmonite mista (batterica e virale)
- Polmonite a microbiologia negativa (segni clinici e radiologici di polmonite, ma nessun germe identificato nel BAL)
- Controllo non-polmonite (pazienti con sospetto iniziale, ma poi diagnosticati con altro)
I Risultati: De-escalation Possibile e Sicura!
E cosa abbiamo scoperto analizzando i punteggi NAT? I risultati sono stati davvero incoraggianti!
Abbiamo osservato un chiaro e consistente pattern di de-escalation antibiotica già nei primi 1-2 giorni dopo il BAL in tutte le categorie di polmonite, con l’unica eccezione, prevedibile, delle polmoniti causate da batteri resistenti.
Ecco alcuni punti salienti:
- Polmoniti a microbiologia negativa: Queste sono state trattate in modo molto simile alle polmoniti batteriche sensibili, suggerendo che i medici si sentivano abbastanza sicuri, grazie ai risultati negativi del BAL, da non usare terapie eccessivamente aggressive.
- Polmoniti virali: Qui la de-escalation è stata ancora più marcata. Pensate che nel 44% dei casi, gli antibiotici sono stati completamente sospesi entro 5 giorni dal BAL! Questo va un po’ contro le attuali linee guida per la polmonite comunitaria (CAP), che suggerirebbero di continuare gli antibiotici anche in caso di diagnosi virale confermata.
- Batteri resistenti vs Sensibili: Come atteso, nelle polmoniti batteriche resistenti il punteggio NAT è rimasto alto, mentre in quelle sensibili è sceso significativamente.
- Tempistiche: Abbiamo stimato che circa il 60% delle de-escalation avvenute entro il quarto giorno nelle polmoniti batteriche sensibili e in quelle a microbiologia negativa fossero probabilmente guidate dai risultati rapidi della PCR, avvenendo già il primo giorno. Le altre sono seguite con i risultati delle colture.
Ma la domanda fondamentale è: questa de-escalation più “aggressiva” ha avuto conseguenze negative per i pazienti? Abbiamo analizzato gli esiti principali: mortalità in ospedale, dimissione verso hospice, o necessità di trapianto di polmone (che abbiamo raggruppato come “esiti sfavorevoli”). Ebbene, non abbiamo trovato differenze significative negli esiti sfavorevoli tra i vari gruppi di polmonite. Anche i pazienti con polmonite virale, dove la de-escalation era maggiore, non hanno avuto esiti peggiori in termini di mortalità rispetto agli altri.
È vero, i pazienti con polmonite virale o mista (la maggior parte dei quali aveva SARS-CoV-2, noto per causare degenze più lunghe) hanno avuto una durata della degenza in terapia intensiva e della ventilazione meccanica significativamente più lunga. Ma questo sembra legato alla malattia virale in sé, piuttosto che alla gestione antibiotica.
Un altro dato importante: l’incidenza di infezioni da Clostridium difficile, una complicanza spesso legata all’uso di antibiotici, è stata bassissima nel nostro gruppo di pazienti (solo il 2%).
Cosa Significa Tutto Questo?
Il nostro studio suggerisce fortemente che utilizzare i dati combinati delle colture quantitative e dei test PCR rapidi su campioni ottenuti tramite BAL permette una de-escalation antibiotica precoce e sicura nei pazienti critici con sospetta polmonite. Dimostra che è possibile trattare le polmoniti a microbiologia negativa in modo meno aggressivo rispetto al passato, con risultati clinici comparabili a quelli delle polmoniti batteriche sensibili.
Questi risultati sono importanti perché affrontano direttamente l’esitazione dei medici nel ridurre gli antibiotici. Fornire dati diagnostici rapidi, specifici e affidabili sembra essere la chiave per promuovere pratiche di antibiotic stewardship più efficaci, in linea con le raccomandazioni delle società scientifiche. Vedere che quasi la metà dei pazienti con polmonite virale ha interrotto gli antibiotici senza conseguenze negative potrebbe anche aprire un dibattito su come aggiornare le linee guida per questi scenari specifici in terapia intensiva.
Abbiamo anche notato che la decisione sulla de-escalation teneva conto del miglioramento clinico del paziente e della presenza di eventuali altre infezioni (extrapolmonari). Questo sottolinea che la gestione rimane un processo complesso che integra i dati di laboratorio con la valutazione clinica complessiva.
Limiti e Prospettive Future
Ovviamente, il nostro studio ha dei limiti. È stato condotto in un singolo centro accademico terziario, con facile accesso a tecnologie avanzate come la PCR multiplex e una pratica consolidata nell’uso del BAL (eseguito anche dai nostri terapisti respiratori). Non tutti gli ospedali hanno queste risorse o questa familiarità con la procedura. Essendo uno studio osservazionale, non possiamo escludere che i medici abbiano scelto strategie meno aggressive per pazienti che stavano già migliorando, e non abbiamo un gruppo di controllo “senza BAL” per un confronto diretto. Inoltre, il numero di casi con batteri multi-resistenti era relativamente basso, quindi l’applicabilità in contesti ad alta prevalenza di MDR andrà verificata.
Tuttavia, crediamo che descrivere nel dettaglio questo pattern di de-escalation quotidiana, quantificato con il NAT score, sia un passo importante. Dimostra la fattibilità e la sicurezza di un approccio più guidato dai dati diagnostici.
Il prossimo passo? Sarebbe fantastico poter condurre studi prospettici randomizzati che confrontino una strategia di de-escalation basata su protocollo (guidata da BAL+PCR) con le cure standard. Questo ci aiuterebbe a validare ulteriormente la sicurezza e l’efficacia di una de-escalation ancora più decisa, soprattutto nei casi virali o a microbiologia negativa.
In conclusione, la combinazione di BAL, colture quantitative e test PCR rapidi sembra essere uno strumento potente per ottimizzare l’uso degli antibiotici nella polmonite dei pazienti critici. Una strada promettente per combattere l’antibiotico-resistenza senza compromettere la cura dei nostri pazienti più fragili.
Fonte: Springer