Reni Sotto Stress: Il Pericolo Nascosto dello Shock Emorragico nel Deserto
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante e, allo stesso tempo, un po’ inquietante che abbiamo studiato di recente. Immaginate una situazione estrema: un trauma grave, una perdita di sangue importante – quello che chiamiamo shock emorragico traumatico (THS) – ma con una complicazione in più: trovarsi in un ambiente desertico, secco e incredibilmente caldo. Cosa succede ai nostri reni in queste condizioni? È quello che abbiamo cercato di scoprire.
Lo shock emorragico di per sé è già un brutto cliente. Quando il corpo perde molto sangue, la pressione cala, i tessuti non ricevono abbastanza ossigeno e nutrimento, e gli organi iniziano a soffrire. I reni, che sono delle vere e proprie centrali di depurazione e regolazione del nostro corpo, sono particolarmente sensibili a questa mancanza di flusso sanguigno. Spesso, una delle complicazioni più gravi del THS è proprio l’insufficienza renale acuta (AKI), una condizione seria con prognosi spesso infausta.
Ma cosa succede se aggiungiamo il fattore “deserto”? Sappiamo che il caldo estremo e la disidratazione tipici di questi ambienti mettono a dura prova l’organismo, reni compresi. Il caldo può causare stress termico, colpi di calore e danneggiare direttamente tessuti e organi. L’AKI è una complicanza comune anche del colpo di calore. Quindi, la nostra ipotesi era: la combinazione di shock emorragico e ambiente desertico potrebbe essere un cocktail micidiale per i reni, peggiorando il danno in modo significativo? E quali meccanismi cellulari entrano in gioco?
L’Esperimento: Maialini nel Deserto (Simulato)
Per capirci qualcosa di più, abbiamo messo in piedi un esperimento utilizzando dei maialini Landrace (un modello animale fisiologicamente abbastanza simile all’uomo per certi aspetti). Li abbiamo divisi in tre gruppi principali:
- Un gruppo sottoposto a THS in un ambiente a temperatura normale (NTS).
- Un gruppo esposto all’ambiente secco e caldo (40.5°C, 10% umidità per 3 ore) ma senza shock (una sorta di gruppo di controllo per il solo effetto ambientale, DHC).
- Il gruppo “clou”: maialini sottoposti a THS dopo essere stati esposti all’ambiente secco e caldo (DHS).
Abbiamo simulato il trauma (con procedure chirurgiche come la rimozione della milza e una lesione controllata al fegato) e poi indotto lo shock emorragico controllando la pressione sanguigna. Durante tutto l’esperimento, durato fino a 180 minuti dopo l’induzione dello shock, abbiamo monitorato attentamente i parametri vitali e prelevato campioni di sangue, urina e tessuto renale a diversi intervalli di tempo. L’obiettivo era vedere come cambiavano gli indicatori di danno renale, infiammazione, stress ossidativo e morte cellulare.
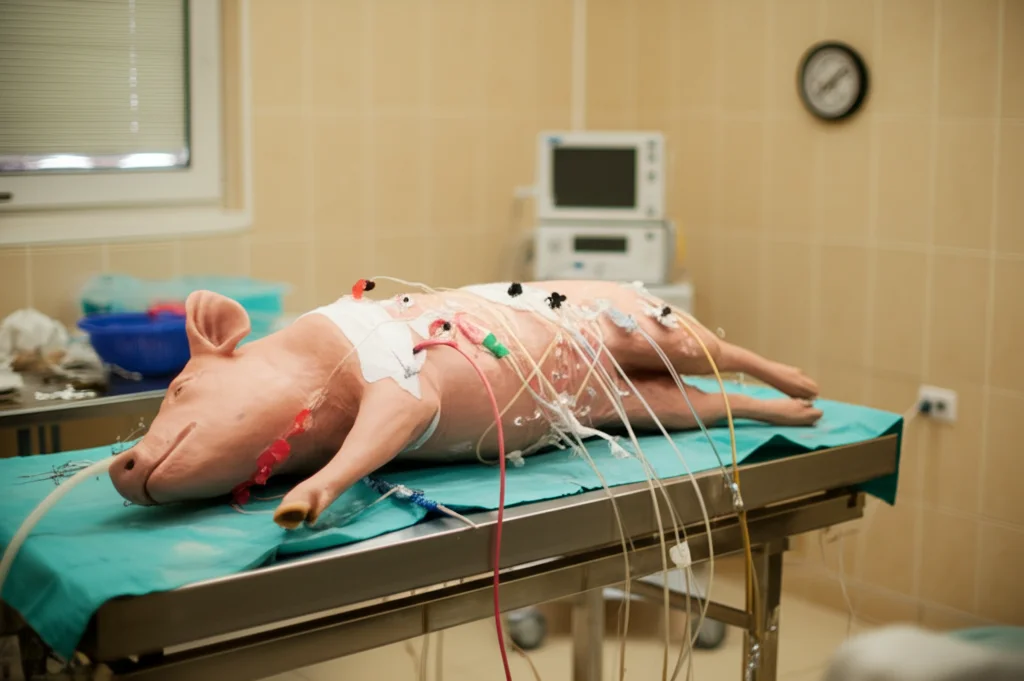
Il Danno Renale Peggiora: I Segnali d’Allarme
I primi risultati hanno confermato i nostri sospetti. Abbiamo misurato i classici indicatori di funzionalità renale nel sangue, come l’azoto ureico (BUN) e la creatinina. In tutti i gruppi con shock (NTS e DHS), questi valori aumentavano nel tempo, segnalando un problema ai reni. Ma nel gruppo DHS (shock + ambiente caldo-secco), l’aumento era significativamente più marcato rispetto agli altri gruppi, specialmente dopo 120 e 180 minuti.
Ancora più interessante è stato guardare a marcatori più precoci di danno renale, come NGAL (Neutrophil Gelatinase-Associated Lipocalin) e KIM-1 (Kidney Injury Molecule 1), misurati nelle urine. Questi sono considerati dei veri e propri campanelli d’allarme precoci per l’AKI. Ebbene, nel gruppo DHS, i livelli di NGAL e KIM-1 schizzavano alle stelle molto prima e in modo molto più evidente rispetto agli altri due gruppi, già a partire da 60 minuti dopo lo shock.
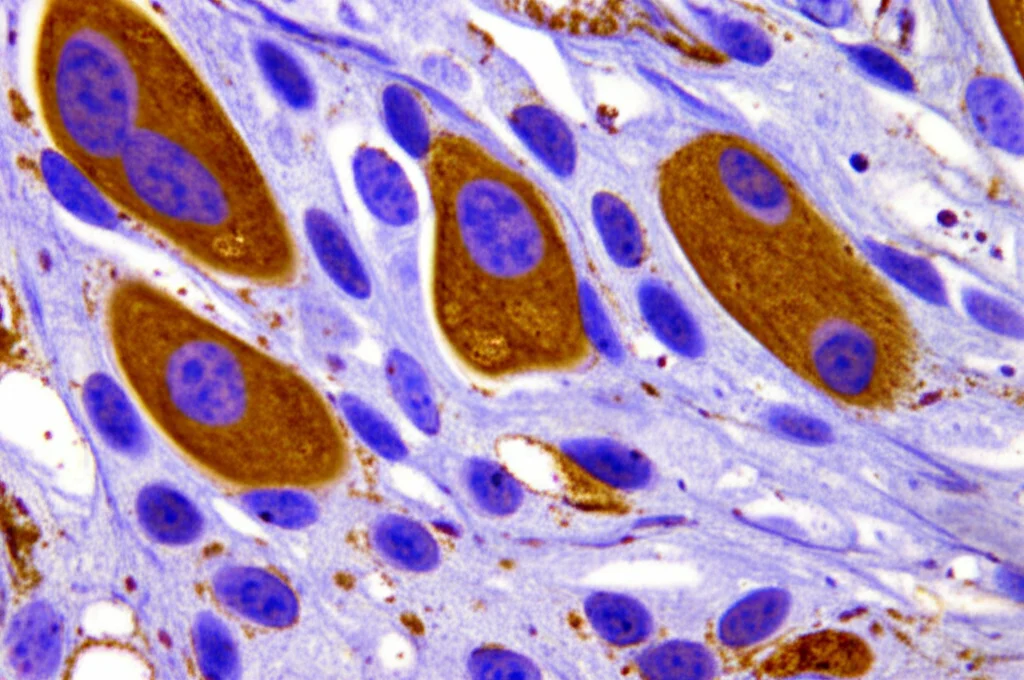
Anche l’analisi al microscopio dei tessuti renali (l’istopatologia) ha raccontato la stessa storia. Utilizzando un sistema di punteggio specifico (il Paller score), abbiamo visto che il danno strutturale ai tubuli e ai glomeruli era decisamente più grave e compariva prima nel gruppo DHS. Vedevamo cellule danneggiate, distaccate, edema… un quadro decisamente peggiore. Insomma, l’ambiente caldo e secco non solo aggiungeva danno, ma accelerava e amplificava quello indotto dallo shock emorragico.
Un Cocktail Infiammatorio Micidiale e la Piroptosi
Ma perché questo peggioramento? Abbiamo iniziato a indagare i meccanismi molecolari. Una delle prime cose che succedono in caso di trauma e shock è il rilascio di segnali di pericolo da parte delle cellule danneggiate (i cosiddetti DAMPs – Damage-Associated Molecular Patterns). Inoltre, in condizioni di stress come il caldo e lo shock, la barriera intestinale può diventare più permeabile, lasciando passare frammenti batterici (come il lipopolisaccaride, LPS) nel sangue. Questi sono i PAMPs (Pathogen-Associated Molecular Patterns). Nel nostro studio, i livelli di LPS nel sangue erano significativamente più alti nel gruppo DHS, suggerendo questo problema di “traslocazione batterica”.
Sia i DAMPs che i PAMPs funzionano come micce che accendono la risposta immunitaria e infiammatoria. Si legano a recettori specifici sulle cellule immunitarie e renali, come i Toll-Like Receptors (TLR4) e i Nod-Like Receptors (NLRs), in particolare NLRP3. L’attivazione di questi recettori scatena una cascata di eventi. Abbiamo visto che nel gruppo DHS, i livelli di proteine come TLR4, NLRP3, ASC e Caspase-1 nel tessuto renale erano significativamente aumentati.
L’attivazione di NLRP3 porta alla formazione di un complesso chiamato “inflammasoma”, che attiva la Caspase-1. Questa, a sua volta, fa due cose principali:
- Promuove il rilascio di potenti citochine pro-infiammatorie come IL-1β e IL-6.
- Taglia un’altra proteina chiamata Gasdermina D (GSDMD), liberando un frammento (GSDMD-N) che va a “bucare” la membrana cellulare, causando un tipo particolare di morte cellulare infiammatoria chiamata piropotosi.
E infatti, nel gruppo DHS abbiamo trovato livelli più alti di IL-1β, IL-6, TNF-α (un’altra citochina pro-infiammatoria) e anche di GSDMD-N. Anche i livelli di NF-κB, un fattore chiave che regola l’espressione di molti geni infiammatori, erano più alti. È come se l’ambiente caldo-secco gettasse benzina sul fuoco dell’infiammazione già accesa dallo shock. Curiosamente, anche i livelli di IL-10, una citochina anti-infiammatoria, aumentavano, forse in un tentativo del corpo di controbilanciare questa tempesta infiammatoria.
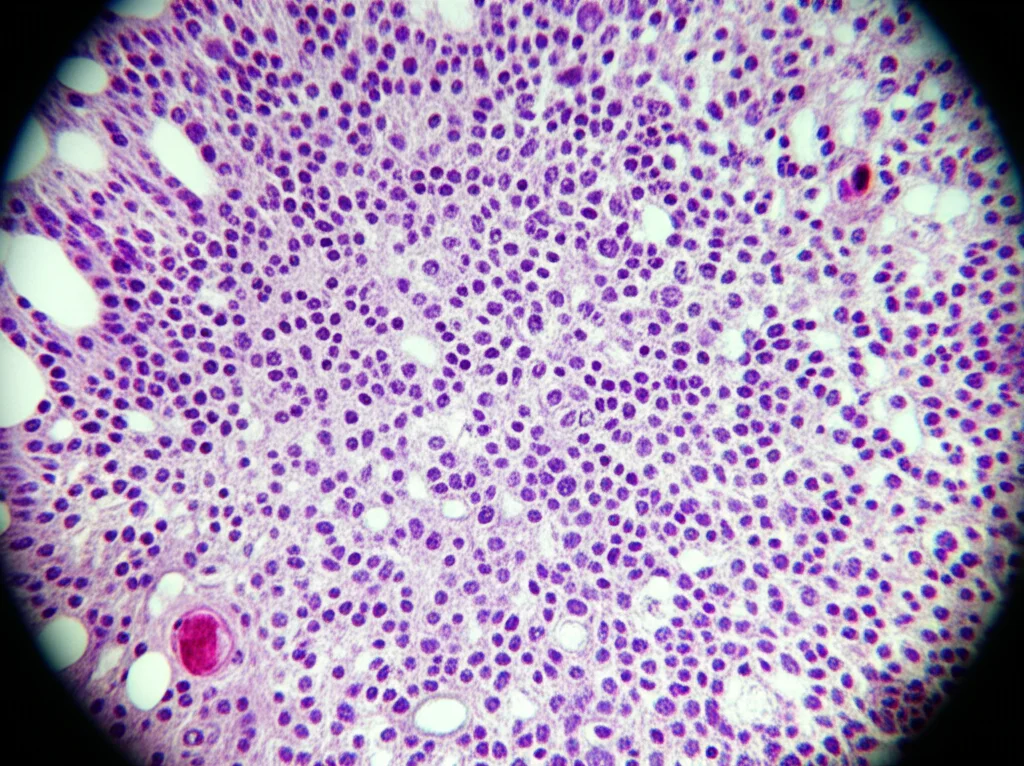
Abbiamo anche osservato un aumento di altre molecole segnale di danno, come HMGB1 e HSP-70 (Heat Shock Protein 70). HMGB1, rilasciato dalle cellule danneggiate, agisce come un DAMP amplificando ulteriormente l’infiammazione. HSP-70 è una proteina prodotta in risposta allo stress (come il calore) che normalmente ha un ruolo protettivo, ma il suo aumento qui potrebbe anche riflettere il livello elevato di stress cellulare. Entrambe erano significativamente più alte nel gruppo DHS.
Stress Ossidativo alle Stelle
Un altro attore chiave in questo dramma cellulare è lo stress ossidativo. Sia lo shock (con la sua mancanza di ossigeno seguita magari da una riperfusione) sia lo stress da calore possono danneggiare i mitocondri, le centrali energetiche delle cellule. Quando i mitocondri non funzionano bene, producono un eccesso di specie reattive dell’ossigeno (ROS), molecole molto instabili che possono danneggiare proteine, lipidi e DNA.
Il corpo ha i suoi sistemi di difesa antiossidante, come gli enzimi SOD (Superossido Dismutasi), CAT (Catalasi) e GPX (Glutatione Perossidasi), e molecole come il glutatione (GSH). Questi sistemi sono regolati da vie di segnalazione come quella di Nrf2/HO-1. Nel nostro studio, abbiamo visto che nel gruppo DHS, le difese antiossidanti erano in difficoltà: i livelli di SOD, CAT e GPX diminuivano significativamente nel tempo, mentre aumentava il livello di MDA (Malondialdeide), un marcatore del danno lipidico causato dai ROS. Anche l’espressione di Nrf2 e HO-1 sembrava ridotta nel gruppo DHS rispetto agli altri, suggerendo che il sistema di difesa antiossidante fosse sopraffatto o addirittura inibito in queste condizioni estreme. Lo stress ossidativo, quindi, contribuiva pesantemente al danno renale.
Apoptosi: Morte Cellulare Programmata
Oltre alla piroptosi (la morte infiammatoria), abbiamo indagato anche l’apoptosi, la classica “morte cellulare programmata”. Anche questo processo sembrava essere potenziato dalla combinazione caldo-secco + shock. Il danno mitocondriale non solo genera ROS, ma può anche innescare l’apoptosi attraverso il rilascio di molecole come il Citocromo C (Cyt-C) nel citoplasma. Questo attiva una cascata di enzimi chiamati Caspasi (in particolare Caspase-9 e Caspase-3) che smantellano ordinatamente la cellula.
Abbiamo usato una tecnica chiamata TUNEL per visualizzare le cellule apoptotiche nel tessuto renale e abbiamo calcolato un indice di apoptosi. Risultato? L’indice era significativamente più alto nel gruppo DHS rispetto agli altri. Coerentemente, anche i livelli delle proteine pro-apoptotiche come Cyt-C, Caspase-9, Caspase-3 e Bax erano aumentati nel gruppo DHS, mentre i livelli della proteina anti-apoptotica Bcl-2 erano diminuiti. Sembra coinvolta anche la via di segnalazione dello stress JNK, un altro induttore dell’apoptosi, i cui livelli erano più alti nel gruppo DHS. Quindi, le cellule renali sotto questo doppio stress morivano più facilmente, contribuendo alla perdita di funzione dell’organo.
Tirando le Somme: Un Circolo Vizioso
Quindi, cosa ci dice tutto questo? Il nostro studio conferma che un ambiente desertico, caldo e secco, di per sé può causare un certo grado di danno ai reni. Ma quando questo si combina con uno shock emorragico traumatico, l’effetto è devastante. Si innesca un circolo vizioso:
- Lo shock e il trauma causano ischemia e rilasciano DAMPs.
- Il caldo e lo stress peggiorano il danno cellulare, potenziano il rilascio di DAMPs e forse compromettono la barriera intestinale, portando al rilascio di PAMPs (LPS).
- DAMPs e PAMPs attivano potentemente l’inflammasoma NLRP3 e altre vie infiammatorie (TLR4/NF-κB), portando a una massiccia produzione di citochine pro-infiammatorie e alla piroptosi (morte cellulare infiammatoria via GSDMD-N).
- Lo stress combinato danneggia i mitocondri, causando un forte stress ossidativo (eccesso di ROS, difese antiossidanti sopraffatte) e innescando l’apoptosi (morte cellulare programmata via Citocromo C/Caspasi).
Tutti questi processi – piroptosi, infiammazione esagerata, stress ossidativo e apoptosi – convergono nel danneggiare gravemente la struttura e la funzione dei reni, portando a un’insufficienza renale acuta più rapida e severa.
Capire questi meccanismi è fondamentale. Ci aiuta a comprendere meglio perché certe situazioni sono così pericolose e, speriamo, potrà aprire la strada a nuove strategie terapeutiche per proteggere i reni e migliorare la prognosi dei pazienti che subiscono traumi gravi in condizioni ambientali estreme. È un campo di ricerca complesso, ma ogni passo avanti nella comprensione può fare la differenza.
Fonte: Springer