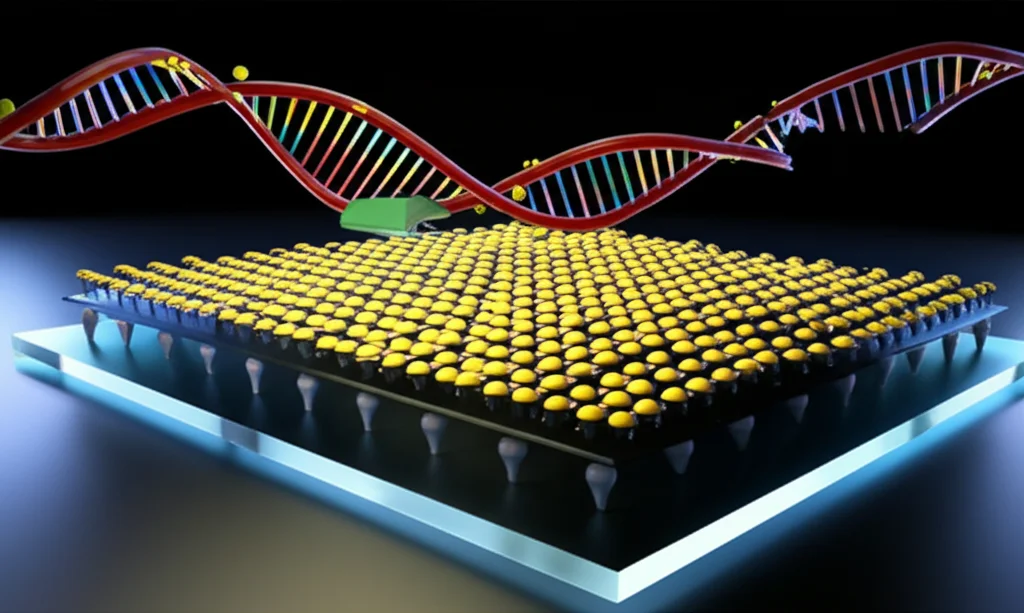
CRISPR e Grafene: Il Duo Dinamico che Rivoluziona la Diagnosi dell’RNA Senza Amplificazione!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi sta davvero appassionando nel campo della diagnostica molecolare. Sapete, identificare acidi nucleici come l’RNA in modo rapido, super sensibile e specifico è una delle sfide cruciali per monitorare la nostra salute, diagnosticare malattie infettive, fare screening genetici e persino scovare il cancro nelle sue fasi iniziali. La velocità e la precisione con cui riusciamo a farlo possono fare davvero la differenza.
Il Problema dei Metodi Tradizionali
Negli ultimi anni abbiamo fatto passi da gigante, passando da tecniche come la PCR quantitativa (qPCR) o l’amplificazione isotermica (LAMP), che richiedono l’amplificazione enzimatica del materiale genetico, a strategie senza enzimi o addirittura a metodi di rilevazione diretta, senza nessuna amplificazione. Il punto è che, sebbene evitare l’amplificazione ci salvi da potenziali contaminazioni e semplifichi le cose, rilevare concentrazioni bassissime di acidi nucleici rimane una bella gatta da pelare. C’è un bisogno disperato di metodi che siano allo stesso tempo sensibilissimi, efficienti, economici e facili da usare.
L’Arrivo di CRISPR: Non Solo Editing Genetico!
Ed è qui che entra in gioco una tecnologia che probabilmente avete già sentito nominare per l’editing genetico: CRISPR. I sistemi CRISPR-Cas sono diventati superstar anche nella diagnostica molecolare grazie alla loro incredibile capacità di “puntare” specifiche sequenze di acidi nucleici. Mentre sistemi come CRISPR-Cas9 (famoso per tagliare il DNA a doppio filamento) hanno qualche limitazione per la diagnostica, altri sistemi, come quelli di tipo V (Cas12) e VI (Cas13), hanno una marcia in più: una volta trovato il loro bersaglio (DNA o RNA), iniziano a tagliare in modo “collaterale” altre molecole di acido nucleico presenti nei dintorni, amplificando così il segnale. Fantastico, vero? Però c’è un “ma”: tendono anche a degradare il bersaglio originale, spegnendo l’attività di taglio collaterale dopo un po’.
Il Potere Nascosto del Sistema CRISPR-Cas10 (Tipo III)
Recentemente, l’attenzione si è spostata su un altro membro della famiglia CRISPR: il sistema di tipo III CRISPR-Cas10. Questo sistema è un po’ diverso: usa un complesso multi-proteico per riconoscere l’RNA bersaglio. La cosa super interessante è che, come il tipo VI, riconosce specificamente l’RNA, ma attiva un’attività diversa: quella di una deossiribonucleasi (DNase) presente nella subunità Cas10, che inizia a tagliare DNA a singolo filamento (ssDNA) nei dintorni. E indovinate un po’? Questo sistema è anche più stabile a temperatura ambiente!
La Nostra Idea: Unire CRISPR-Cas10 e Grafene
Qui arriva la parte che mi entusiasma di più. Abbiamo pensato: e se combinassimo questo fantastico sistema CRISPR-Cas10 con un’altra tecnologia all’avanguardia, i transistor a effetto di campo a base di grafene (GFET)? I GFET sono incredibilmente sensibili alle cariche elettriche sulla loro superficie. Il grafene, con il suo strato ultrasottile, l’alta mobilità dei portatori di carica e la buona biocompatibilità, è perfetto per costruire biosensori ultra-sensibili.
Abbiamo quindi sviluppato un biosensore, che abbiamo chiamato CRISPR-GFET. L’idea è questa:
- Prendiamo il nostro GFET.
- Modifichiamo la sua superficie con nanoparticelle d’oro (AuNPs).
- Attacchiamo a queste nanoparticelle delle “sonde” fatte di DNA a singolo filamento, ma ripiegate a formare una struttura a forcina (hairpin DNA, o re-hpDNA). Queste sonde hanno una carica negativa bella densa.
- Prepariamo il nostro complesso CRISPR-Cas10 (di tipo III-A, proveniente da Lactobacillus delbrueckii), ma con una piccola, geniale modifica: una mutazione nella subunità Csm3 (chiamata dCsm3). Questa mutazione impedisce al complesso di degradare l’RNA bersaglio una volta che l’ha trovato.
Come Funziona il Rilevamento?
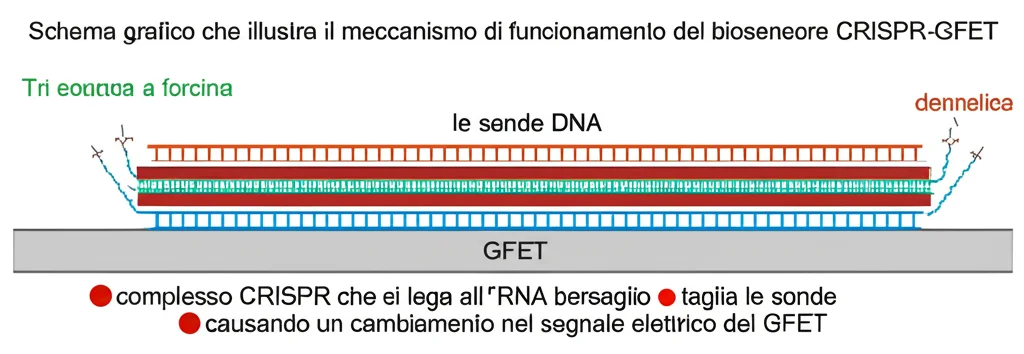
Quando mescoliamo il nostro campione (ad esempio, un tampone faringeo o siero) con il complesso CRISPR-Cas10 modificato (LdCsm-dCsm3) e lo mettiamo a contatto con il nostro chip CRISPR-GFET, succede questo:
- Se l’RNA bersaglio è presente nel campione, il complesso LdCsm-dCsm3 lo riconosce e si attiva.
- L’attività DNase della subunità Cas10 si “accende”.
- Questa DNase inizia a tagliare le sonde re-hpDNA attaccate alla superficie del GFET.
- Poiché il complesso LdCsm-dCsm3 non degrada l’RNA bersaglio (grazie alla mutazione dCsm3!), continua a rimanere attivo e a tagliare tantissime sonde re-hpDNA. È un’auto-amplificazione del segnale senza amplificazione dell’acido nucleico!
- Il taglio e il distacco delle sonde re-hpDNA (che sono cariche negativamente) dalla superficie del grafene cambia l’ambiente elettrico locale.
- Il GFET rileva questo cambiamento come una variazione del suo segnale elettrico (specificamente, uno spostamento del “punto di Dirac”).
Se l’RNA bersaglio non c’è, il complesso non si attiva, le sonde restano al loro posto e il segnale del GFET non cambia significativamente. Semplice ed elegante!
Risultati da Urlo: Sensibilità e Specificità Estreme
Abbiamo testato il nostro CRISPR-GFET e i risultati sono stati pazzeschi. Siamo riusciti a rilevare RNA di media lunghezza e microRNA (miRNA) con limiti di rilevamento nell’ordine degli attomoli (aM) – parliamo di 214 aM per l’RNA e 427 aM per i miRNA! Questo significa una sensibilità altissima, senza bisogno di amplificare nulla.
Abbiamo anche verificato la specificità: il sensore riconosce il bersaglio giusto e non si fa ingannare da RNA simili o non correlati. Addirittura, abbiamo testato la capacità di distinguere miRNA con differenze di singole basi (anche se qui la distinzione è più sfumata, ma potenzialmente migliorabile progettando crRNA specifici).
Un altro punto forte è la versatilità. Grazie alla programmabilità del sistema CRISPR (basta cambiare il crRNA guida), possiamo adattare il sensore per rilevare praticamente qualsiasi sequenza di RNA ci interessi.
Test sul Campo: Funziona Anche nel “Mondo Reale”
La vera prova del nove è stata testare il sistema su campioni biologici complessi, come tamponi faringei e siero umano, senza fare estrazione, purificazione o amplificazione. Ebbene, il nostro CRISPR-GFET ha mostrato un’ottima resistenza alle interferenze presenti in questi campioni, con recuperi accurati (tra l’81.68% e il 98.81% nei tamponi).
Ancora più emozionante, abbiamo usato il sensore per rilevare il miRNA-155, un biomarcatore associato al cancro al seno. Abbiamo analizzato campioni di siero di individui sani (N=5) e pazienti con cancro al seno (N=6). Il risultato? Il nostro biosensore è stato in grado di distinguere chiaramente i pazienti dai controlli sani, rilevando livelli significativamente più alti di miRNA-155 nei pazienti, il tutto direttamente dal siero, senza passaggi intermedi! Questo riduce drasticamente i tempi di analisi e il rischio di falsi positivi legati all’amplificazione.
Perché Questo Sistema è Speciale?
Rispetto ad altri metodi basati su CRISPR (come quelli che usano Cas13), il nostro approccio basato su LdCsm-dCsm3 ha diversi vantaggi:
- Usa DNA come reporter, che è più stabile dell’RNA.
- La mutazione dCsm3 permette un’auto-amplificazione del segnale senza degradare il bersaglio.
- Il sistema LdCsm sembra meno influenzato da RNA non specifici, migliorando la specificità.
- Il complesso LdCsm è più stabile a temperatura ambiente, riducendo la necessità della catena del freddo.
Inoltre, integrando questo sistema CRISPR con la sensibilità del GFET e usando la sonda a forcina ad alta densità di carica, abbiamo superato i limiti di sensibilità precedenti, ottenendo una piattaforma più semplice, stabile e robusta.
Il Futuro è Adesso (e nel Palmo di una Mano?)
Credo davvero che questa piattaforma CRISPR-GFET apra scenari incredibili. Potrebbe diventare uno strumento diagnostico universale per l’RNA, applicabile alla rilevazione di patogeni, allo screening di biomarcatori genetici, alla diagnosi di malattie associate a specifici RNA. Immaginate di poter fare analisi multiplex, rilevando più RNA contemporaneamente usando array di sensori GFET.
Essendo una tecnologia che non richiede amplificazione, semplifica enormemente il processo, riduce i rischi di contaminazione e si presta benissimo per test rapidi sul punto di cura (Point-of-Care, POC). E guardando ancora più avanti, potremmo miniaturizzare ulteriormente la piattaforma GFET e integrarla con dispositivi portatili, come gli smartphone, per test remoti e in tempo reale. Monitoraggio continuo della salute, trasmissione dati istantanea… un passo enorme verso una medicina più personalizzata e una diagnosi più precisa.
Insomma, siamo solo all’inizio, ma la combinazione di CRISPR-Cas10 e GFET promette di essere una vera rivoluzione nella diagnostica molecolare!
Fonte: Springer