COVID, Parkinson e quel Mix Pericoloso: Quando Virus, Geni e Ambiente si Incontrano nel Cervello
Avete mai pensato a cosa succede nel nostro cervello dopo un’infezione virale come il COVID-19? Sembra fantascienza, ma la ricerca sta svelando legami sempre più intriganti tra virus e malattie neurodegenerative come il Parkinson. Recentemente, mi sono imbattuto in uno studio affascinante che getta nuova luce su questa complessa interazione, e voglio raccontarvelo perché tocca corde molto profonde sulla nostra salute.
L’idea di base è che il morbo di Parkinson non sia quasi mai causato da un singolo fattore. Immaginate una sorta di “tempesta perfetta” nel nostro organismo: la cosiddetta “ipotesi dei colpi multipli”. Questa teoria suggerisce che diversi “colpi” – come l’esposizione a tossine ambientali, infezioni virali e una certa predisposizione genetica – possano sommarsi nel tempo, portando alla fine alla malattia.
Il COVID-19 entra in scena: un nuovo attore nel dramma del Parkinson?
Lo studio che ho letto si è concentrato proprio sul SARS-CoV-2, il virus responsabile della pandemia di COVID-19. Ci siamo chiesti: un’infezione da questo virus, da sola o combinata con altri fattori noti per essere legati al Parkinson, può aumentare il rischio di sviluppare problemi neurologici simili a quelli della malattia?
Per capirlo, i ricercatori hanno usato modelli animali (topi, in questo caso) ingegnerizzati per essere suscettibili al SARS-CoV-2. Hanno infettato questi topi con due ceppi diversi del virus: il ceppo originale WA-1/2020 (quello che ha dato inizio a tutto, per intenderci) e il più recente ceppo Omicron (B1.1.529), noto per causare sintomi generalmente meno gravi negli esseri umani.
La prima sorpresa è stata che, nonostante Omicron causasse molta meno mortalità e sintomi più lievi nei topi (proprio come negli umani), entrambi i ceppi virali hanno mostrato una capacità simile di “sensibilizzare” il cervello a un successivo insulto.
L’incontro fatale: Virus e Tossine Ambientali
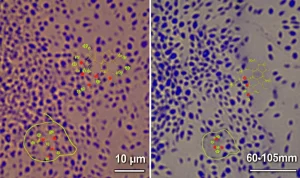
Qui entra in gioco il concetto di “colpi multipli”. Dopo che i topi si erano ripresi dall’infezione virale (circa 30 giorni dopo), sono stati esposti a una dose molto bassa – considerata “subtossica”, cioè non dannosa di per sé – di una tossina chiamata MPTP. L’MPTP è una sostanza chimica tristemente nota per la sua capacità di danneggiare selettivamente i neuroni dopaminergici nella substantia nigra pars compacta (SNpc), l’area del cervello colpita nel Parkinson, inducendo sintomi parkinsoniani.
Ebbene, cosa è successo? Nei topi che avevano avuto il COVID (sia WA-1 che Omicron) e poi erano stati esposti all’MPTP, si è verificata una perdita significativa di questi preziosi neuroni dopaminergici (circa il 24-27%) e un aumento dell’infiammazione cerebrale (neuroinfiammazione), misurata osservando le cellule immunitarie del cervello, le microglia. Nei topi che avevano ricevuto solo il virus o solo l’MPTP a basso dosaggio, invece, questo danno non c’era!
Questo significa che l’infezione da SARS-CoV-2, anche se apparentemente superata, aveva lasciato il cervello più vulnerabile, più “sensibile” a un secondo attacco, in questo caso chimico. È come se il virus avesse preparato il terreno per l’MPTP.
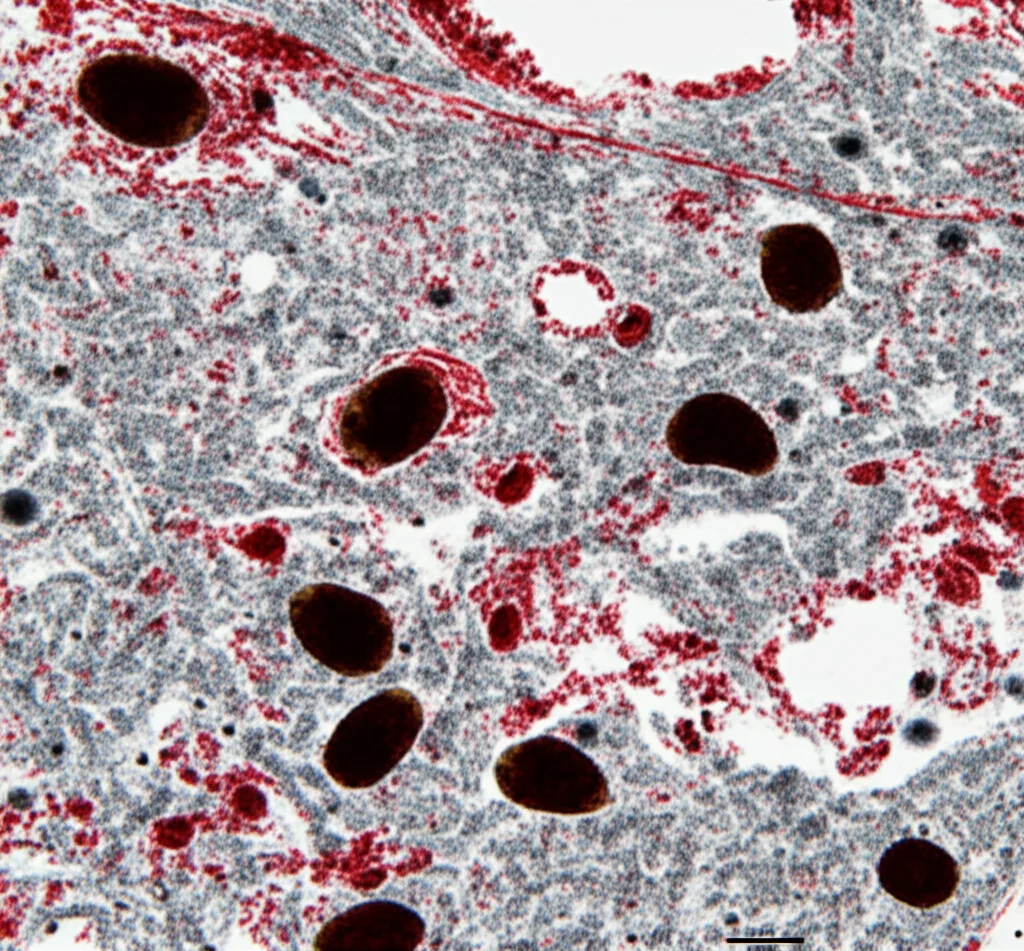
Curiosamente, lo stesso effetto non è stato osservato con un’altra tossina ambientale legata epidemiologicamente al Parkinson, il paraquat (un erbicida). Né il paraquat da solo, né in combinazione con l’infezione da SARS-CoV-2, ha causato danni significativi ai neuroni dopaminergici o infiammazione nei modelli usati. Questo suggerisce che l’interazione tra virus e tossine potrebbe essere molto specifica, forse legata a particolari meccanismi cellulari. L’MPTP agisce principalmente sui mitocondri (le centrali energetiche delle cellule), mentre il paraquat causa stress ossidativo attraverso altri meccanismi. Forse il SARS-CoV-2 rende i mitocondri particolarmente fragili? È un’ipotesi affascinante.
Il fattore genetico: quando il DNA gioca la sua parte
Ma l’ambiente non è tutto. Sappiamo che circa il 10-15% dei casi di Parkinson ha una base genetica. Una delle mutazioni più comuni associate a un aumentato rischio di Parkinson è la G2019S nel gene LRRK2. Questo gene è importante per molte funzioni cellulari, inclusa la risposta immunitaria.
Cosa succede se un individuo (o un topo, nel nostro caso) ha questa mutazione e viene infettato da SARS-CoV-2? I ricercatori hanno creato topi che esprimevano sia il recettore ACE2 umano (per permettere l’infezione da SARS-CoV-2) sia la mutazione G2019S LRRK2.
I risultati sono stati netti: questi topi con la mutazione LRRK2 erano ancora più suscettibili agli effetti neurologici del virus rispetto ai topi senza la mutazione. Già la sola infezione da SARS-CoV-2 (sia WA-1 che Omicron), senza nemmeno bisogno dell’MPTP, causava in questi topi una perdita di circa il 20% dei neuroni dopaminergici e una significativa attivazione della microglia.
Non solo: l’analisi delle citochine e chemochine (molecole segnale del sistema immunitario) nel cervello e nei polmoni ha rivelato una risposta infiammatoria molto più accentuata e persistente nei topi LRRK2 rispetto ai controlli. Alcune molecole pro-infiammatorie rimanevano elevate nel cervello anche 30 giorni dopo l’infezione, suggerendo un’infiammazione cronica latente. Sembra proprio che questa mutazione genetica renda il sistema immunitario, sia nel corpo che nel cervello, più “reattivo” e meno capace di spegnere l’infiammazione dopo l’attacco virale.

I Vaccini: Uno Scudo Anche per il Cervello?
A questo punto, la domanda sorge spontanea: i vaccini contro il COVID-19 possono proteggere anche da questi rischi neurologici a lungo termine? Lo studio ha testato due tipi di vaccini molto diversi:
- Un vaccino a mRNA (simile a Pfizer/BioNTech e Moderna), che istruisce le nostre cellule a produrre la proteina Spike del virus.
- Un vaccino a base proteica (CORAVAX, basato su un vettore del virus della rabbia inattivato che esprime la proteina Spike), più tradizionale come approccio.
Nei topi senza la mutazione LRRK2, entrambi i vaccini si sono dimostrati efficaci. Hanno protetto dalla mortalità causata dal virus e, cosa fondamentale, hanno completamente annullato la perdita di neuroni e l’infiammazione cerebrale indotte dalla combinazione SARS-CoV-2 + MPTP. Un risultato davvero incoraggiante!
Ma la vera sorpresa è arrivata con i topi portatori della mutazione G2019S LRRK2. Qui, le cose si sono complicate:
- Il vaccino a mRNA, pur proteggendo dalla malattia grave e dalla morte, non è riuscito a prevenire la perdita di neuroni dopaminergici e l’infiammazione cerebrale causate dal virus in questi topi geneticamente predisposti. La risposta immunitaria nel cervello rimaneva sregolata.
- Il vaccino a base proteica (CORAVAX), invece, ha funzionato! Ha protetto completamente anche i topi LRRK2 dalla neurodegenerazione e dalla neuroinfiammazione indotte dal virus.
Questa differenza è cruciale. Suggerisce che il tipo di risposta immunitaria indotta dai diversi vaccini potrebbe interagire in modo diverso con un background genetico specifico. Forse i vaccini a mRNA e quelli a base proteica stimolano diversi “rami” del sistema immunitario (ad esempio, diversi sottotipi di anticorpi IgG), e nei soggetti con LRRK2 mutato, solo la risposta indotta dal vaccino proteico è sufficiente a calmare l’iper-reattività immunitaria nel cervello.

Cosa ci portiamo a casa da tutto questo?
Questo studio, sebbene condotto su modelli animali, apre scenari importanti e qualche preoccupazione.
Innanzitutto, conferma che un’infezione da SARS-CoV-2, indipendentemente dal ceppo e dalla gravità iniziale dei sintomi, potrebbe rappresentare un fattore di rischio aggiuntivo per lo sviluppo futuro di malattie neurodegenerative come il Parkinson, specialmente in combinazione con altri fattori ambientali o genetici. L’idea della “tempesta perfetta” o dei “colpi multipli” ne esce rafforzata.
In secondo luogo, sottolinea l’importanza cruciale della vaccinazione. I vaccini non solo ci proteggono dalla malattia acuta, ma sembrano offrire uno scudo anche contro queste potenziali conseguenze neurologiche a lungo termine.
Infine, solleva una questione affascinante e complessa: potrebbe essere necessario, in futuro, personalizzare le strategie vaccinali in base al background genetico individuale? Per le persone portatrici di mutazioni come la G2019S LRRK2 (che sono milioni nel mondo), un tipo di vaccino potrebbe essere più protettivo di un altro, almeno per quanto riguarda i rischi neurologici.
Ovviamente, siamo ancora nel campo della ricerca preclinica, ma questi risultati ci spingono a tenere alta l’attenzione sulle possibili conseguenze a lungo termine del COVID-19, specialmente sul nostro organo più complesso e prezioso: il cervello. E ci ricordano, ancora una volta, quanto sia intricata e meravigliosamente complessa la biologia umana, un delicato equilibrio tra geni, ambiente e… sì, anche i virus che incontriamo lungo il nostro cammino.
Fonte: Springer