Clofoctol: Un Vecchio Antibiotico Rivela un Potenziale Incredibile Contro il Cancro Gastrico!
Amici, preparatevi perché oggi vi racconto una storia che ha dell’incredibile, una di quelle scoperte che ti fanno dire: “Ma dai, davvero?”. Parliamo di un nemico subdolo, il cancro gastrico, e di come un farmaco che conoscevamo per tutt’altro potrebbe diventare una nuova, potentissima arma per combatterlo. E non un farmaco qualsiasi, ma uno che va a colpire proprio al cuore del problema: le famigerate cellule staminali tumorali gastriche (GCSC).
Il Problema delle Cellule Staminali Tumorali: Le Dure a Morire
Vedete, il cancro gastrico è una brutta bestia, una delle principali cause di morte per tumore a livello globale. Uno dei motivi per cui è così difficile da sconfiggere è la presenza di queste GCSC. Immaginatele come le “regine” del tumore: sono loro che danno il via a tutto, che guidano la progressione, che causano le recidive e, ciliegina sulla torta (amara, in questo caso), che resistono alle terapie. Un vero incubo! Le terapie attuali, come il 5-fluorouracile e il cisplatino, spesso colpiscono le cellule tumorali più “mature” e in attiva proliferazione, ma lasciano indenni queste GCSC, pronte a ripopolare il tumore non appena si abbassa la guardia. Ecco perché, anche dopo una risposta iniziale positiva, molti pazienti vedono il tumore tornare più aggressivo di prima.
Negli anni, la ricerca si è concentrata su come mettere KO queste cellule staminali. Si è visto, ad esempio, che la via di segnalazione Wnt/β-catenina gioca un ruolo cruciale nella loro auto-rigenerazione e chemioresistenza. La β-catenina, in particolare, è un bersaglio terapeutico molto attraente. Sono stati sviluppati diversi inibitori, ma, ahimè, nessuno è ancora arrivato all’uso clinico. C’era bisogno di qualcosa di nuovo, magari qualcosa di già esistente e approvato, che potesse essere “riciclato” per questa nuova battaglia.
La Scoperta Inattesa: Clofoctol Entra in Scena
E qui arriva il colpo di scena! I ricercatori hanno deciso di fare uno screening ad ampio raggio: hanno preso ben 206 farmaci già approvati dalla FDA (l’ente regolatorio americano) e li hanno testati per vedere se qualcuno fosse in grado di ridurre i livelli di β-catenina nelle cellule di cancro gastrico. E indovinate un po’? Tra tutti questi, uno in particolare ha brillato: il Clofoctol (CFT). Sì, proprio lui, un vecchio antibiotico usato principalmente per infezioni lievi delle alte vie respiratorie, soprattutto nei bambini. Chi l’avrebbe mai detto?
Il Clofoctol ha mostrato una capacità impressionante di abbassare i livelli di mRNA della β-catenina. Ma non è tutto. Gli studi hanno rivelato che il CFT non si limita a questo:
- Riduce le caratteristiche “staminali” delle cellule tumorali, sia in vitro (in laboratorio) che in vivo (su modelli animali).
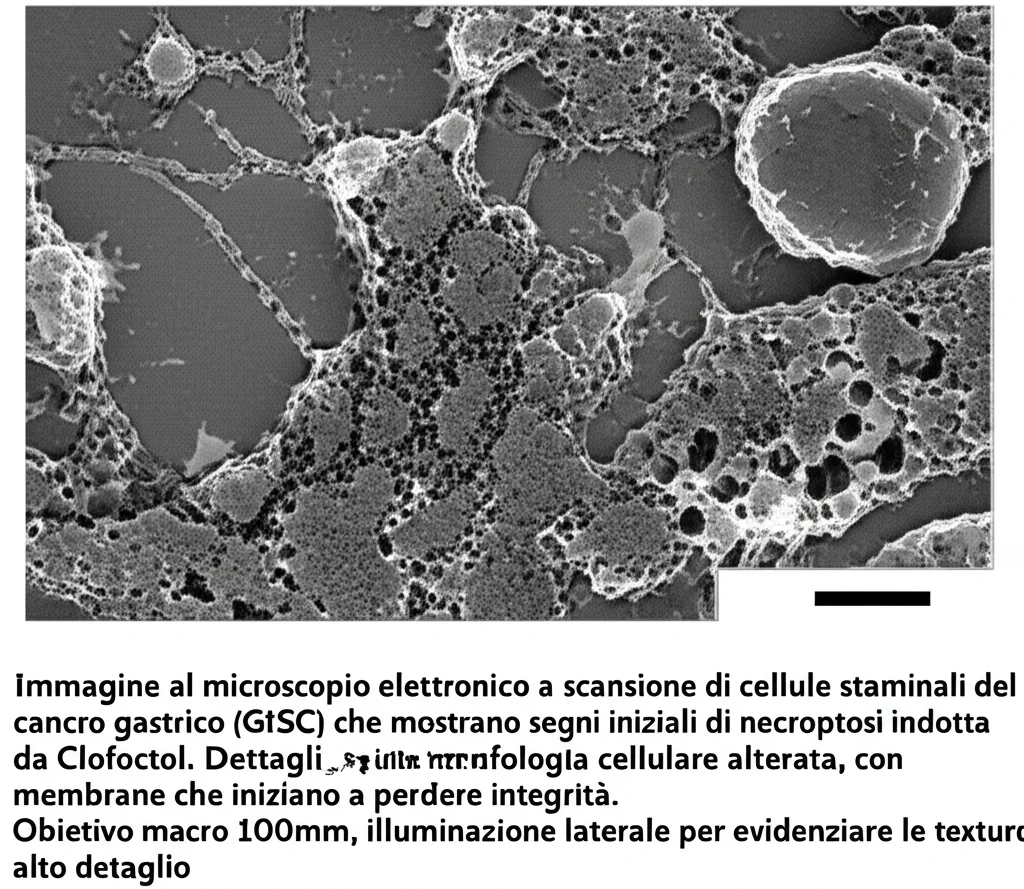
- Induce la necroptosi delle GCSC. Aspettate, necroptosi? Sì, è una forma di morte cellulare programmata, una specie di “suicidio controllato” della cellula, mediata dal TNF (Tumor Necrosis Factor).
Pensateci: un farmaco che non solo frena la “regina” del tumore ma la spinge anche a autodistruggersi! Sembra quasi la trama di un film di fantascienza, e invece è scienza pura.
Come Agisce il Clofoctol? Un Meccanismo Sofisticato
Ma come fa questo “vecchio” antibiotico a compiere tali prodezze? La ricerca non si è fermata alla superficie. Analizzando più a fondo, si è scoperto che il Clofoctol agisce legandosi direttamente a una proteina chiamata RanBP2 (Ran-binding protein 2), nota anche come Nup358. Questa RanBP2 è una nucleoporina, un componente importante del complesso del poro nucleare, la “dogana” della cellula che regola il passaggio di molecole dentro e fuori dal nucleo.
Questo legame diretto con RanBP2 sembra essere la chiave di volta. Ecco cosa succede a cascata:
- Il legame CFT-RanBP2 sopprime l’asse SerpinE1/β-catenina. SerpinE1 (nota anche come PAI-1) è una proteina che, quando iper-espressa nel cancro gastrico, è associata a una prognosi infausta e a caratteristiche di staminalità più spiccate. Il CFT, riducendo SerpinE1, contribuisce a diminuire i livelli di β-catenina e quindi a intaccare la “staminalità” delle cellule tumorali.
- Attiva la necroptosi mediata dal TNF. Il CFT, attraverso questo meccanismo, porta all’attivazione della via di segnalazione RIPK1/RIPK3/MLKL, che culmina nella morte cellulare programmata delle GCSC.
È interessante notare che RanBP2 è una ligasi SUMO E3, coinvolta in un processo chiamato SUMOilazione, che modifica altre proteine. Si ipotizza che il legame del CFT a RanBP2 possa inibire la SUMOilazione di proteine bersaglio, ma questa è una pista che richiederà ulteriori conferme sperimentali. Un altro aspetto emerso è che il CFT induce un accumulo di specie reattive dell’ossigeno (ROS) a livello mitocondriale nelle GCSC, e questo stress ossidativo potrebbe contribuire ad attivare lo stress del reticolo endoplasmatico, un altro fattore che può innescare la necroptosi.
Le Prove sul Campo: Dalle Cellule ai Modelli Animali
Ovviamente, non bastano le belle parole e le ipotesi affascinanti. Servono prove concrete. Ebbene, i ricercatori le hanno fornite!
- In vitro: Hanno utilizzato diverse linee cellulari di cancro gastrico e persino organoidi tumorali (mini-tumori coltivati in laboratorio). Il CFT ha ridotto efficacemente la vitalità delle GCSC, la loro capacità di formare colonie e sferoidi tumorali (indicatori di staminalità). Ha anche indotto l’apoptosi (un’altra forma di morte cellulare programmata) e la già citata necroptosi. È emerso che le GCSC, spesso resistenti ai chemioterapici classici come 5-Fu e Cisplatino, erano invece sensibili al CFT.
- In vivo: Sono stati usati modelli murini (topi) a cui sono state iniettate cellule di cancro gastrico. Il trattamento con CFT ha inibito significativamente la crescita tumorale, senza causare effetti tossici rilevanti sul peso corporeo o su organi come fegato e milza. Nei tumori trattati con CFT, si è osservata una riduzione dei marcatori di staminalità (come CD44 e CD133) e un aumento dei segnali di morte cellulare.
Un’analisi particolarmente sofisticata, chiamata single-cell RNA sequencing (scRNA-seq), eseguita sui tumori dei topi, ha permesso di “zoomare” sulle singole cellule e ha confermato che il CFT colpisce proprio le popolazioni cellulari con caratteristiche staminali, quelle più immature e pericolose.
SerpinE1 e TNF: Attori Chiave nel Dramma Cellulare
L’analisi dell’espressione genica (RNA-seq) ha messo in luce due protagonisti principali nell’azione del Clofoctol: SerpinE1 e TNF.
Come accennato, SerpinE1 è un cattivo noto nel cancro gastrico. Alti livelli di SerpinE1 sono correlati a una prognosi peggiore. Lo studio ha confermato che il CFT ne riduce l’espressione. E c’è di più: quando i ricercatori hanno artificialmente aumentato i livelli di SerpinE1 nelle cellule tumorali, questo ha parzialmente annullato gli effetti benefici del CFT sulla β-catenina e sulla staminalità. Questo suggerisce che la β-catenina potrebbe essere un bersaglio a valle di SerpinE1, e che il CFT agisce proprio su questo asse.
Dall’altro lato, il TNF è emerso come un gene centrale nella rete di interazioni che portano alla morte delle GCSC indotta da CFT. Il farmaco aumenta i livelli di TNF e attiva la cascata della necroptosi (fosforilazione di RIPK1, RIPK3 e MLKL). Per confermare questo meccanismo, i ricercatori hanno usato un inibitore della necroptosi (Necrostatin-1, Nec-1). Ebbene, Nec-1 ha ridotto l’aumento di TNF indotto da CFT e ha diminuito il numero di cellule apoptotiche/necroptotiche, confermando che il CFT uccide le GCSC proprio attraverso questa via.
Verso una Terapia Personalizzata? Il Modello Predittivo a 13 Geni
Un aspetto davvero proiettato al futuro di questa ricerca è lo sviluppo di un modello predittivo basato su 13 geni. Utilizzando algoritmi di machine learning (come Lasso regression, Support Vector Machine e Random Forest) sui dati di espressione genica, i ricercatori hanno identificato un gruppo di 77 geni candidati. Integrando questi dati con quelli del database TCGA (The Cancer Genome Atlas), sono arrivati a un “set” di 13 geni la cui espressione combinata potrebbe aiutare a predire la risposta al trattamento con Clofoctol.
Questo modello ha mostrato un valore prognostico interessante: i pazienti con un “punteggio di rischio” più alto (basato su questi 13 geni) avevano una sopravvivenza globale più breve. Sebbene il modello necessiti di ulteriori validazioni, apre la strada a un approccio più personalizzato: in futuro, si potrebbe analizzare il profilo genetico del tumore di un paziente per capire se il Clofoctol potrebbe essere particolarmente efficace per lui.
Cosa Ci Riserva il Futuro?
Quindi, cosa significa tutto questo? Significa che abbiamo tra le mani un farmaco, il Clofoctol, già approvato per altri usi, che mostra un potenziale enorme e inaspettato contro il cancro gastrico. La sua capacità di colpire le cellule staminali tumorali, responsabili delle recidive e della resistenza, e di farlo attraverso un meccanismo d’azione così specifico (legandosi a RanBP2 e modulando l’asse SerpinE1/β-catenina e la via della necroptosi TNF-mediata) è davvero promettente.
Certo, la strada dalla ricerca di laboratorio alla clinica è lunga e piena di ostacoli. Serviranno ulteriori studi, trial clinici per confermare questi risultati sull’uomo. Ma la speranza è tanta. L’idea di “riciclare” un vecchio antibiotico per una battaglia così importante è affascinante e potrebbe aprire nuove prospettive terapeutiche per i pazienti affetti da cancro gastrico.
Io, personalmente, trovo queste scoperte elettrizzanti. Ci dimostrano come la ricerca, con la sua curiosità e perseveranza, possa scovare soluzioni impensate nei posti più inaspettati. E chissà quante altre “vecchie conoscenze” aspettano solo di essere riscoperte per nuovi, eroici compiti!
Fonte: Springer