CLAVATA: Sveliamo i Segreti della Crescita della Spiga d’Orzo!
Ciao a tutti gli appassionati di scienza e natura! Oggi voglio portarvi con me in un viaggio affascinante nel cuore di una delle piante più importanti per l’uomo: l’orzo (*Hordeum vulgare*). Avete mai osservato da vicino una spiga d’orzo e vi siete chiesti come fa a sviluppare quella sua forma così caratteristica, con tutti quei chicchi allineati? Beh, la risposta, o almeno una parte importante di essa, si nasconde in un complesso sistema di segnalazione molecolare chiamato CLAVATA (CLV). Pensatelo un po’ come un direttore d’orchestra che coordina la crescita e lo sviluppo della pianta.
Nel nostro studio, ci siamo concentrati proprio su come questa via di segnalazione CLAVATA riesca a “scolpire” l’infiorescenza dell’orzo, ovvero la struttura che porta i fiori e poi i chicchi. In particolare, abbiamo indagato come controlla l’attività e il destino dei meristemi. Cosa sono i meristemi? Immaginateli come delle piccole “fabbriche” di cellule staminali vegetali, situate nelle punte dei germogli (meristema apicale del germoglio o SAM) e in altre zone di crescita attiva, responsabili della formazione di nuove foglie, fusti e, appunto, delle strutture dell’infiorescenza.
I Protagonisti: HvCLV1 e HvFCP1
Al centro di questa storia ci sono due attori principali che abbiamo identificato nell’orzo:
- Una proteina recettore chiamata HvCLV1 (Hordeum vulgare CLAVATA1). Pensatela come un’antenna sulla superficie delle cellule, pronta a ricevere segnali.
- Una piccola proteina segnale (un peptide) chiamata HvFCP1 (FON2-LIKE CLE PROTEIN1). Questo è il messaggero che si lega all’antenna HvCLV1.
Abbiamo scoperto che questi due lavorano in coppia. HvFCP1 si lega a HvCLV1 e insieme danno il via a una serie di istruzioni cellulari. La loro azione combinata è fondamentale: da un lato, promuovono la formazione delle spighette (le unità base che contengono i fiori), ma dall’altro lato, limitano la crescita eccessiva del meristema principale dell’infiorescenza (IM) e della rachilla. La rachilla è l’asse corto su cui si sviluppano i fiori all’interno di ogni spighetta. È un equilibrio delicato!
Cosa Succede Quando il Sistema si Rompe? I Mutanti ci Svelano i Segreti
Per capire meglio la funzione di HvCLV1 e HvFCP1, abbiamo usato la tecnica rivoluzionaria CRISPR-Cas9 per creare delle piante di orzo “mutanti”, in cui questi geni erano spenti o non funzionanti. E qui le cose si sono fatte davvero interessanti!
Le piante senza un HvCLV1 o un HvFCP1 funzionante mostravano delle caratteristiche decisamente particolari:
- File extra di spighette: Alcune spighe, soprattutto nelle mutanti Hvclv1, sviluppavano file addizionali di spighette, crescendo in modo disordinato invece che nel classico schema a due file (o sei file, a seconda della varietà). Abbiamo chiamato questo fenomeno “spighe coronate”. Immaginate una crescita un po’ anarchica!
- Fiori soprannumerari: La rachilla, che normalmente nell’orzo produce un solo fiore fertile per spighetta (nella spighetta centrale), nelle piante mutanti continuava a crescere più a lungo del dovuto, producendo due o addirittura tre fiori all’interno della stessa spighetta. Questo portava alla formazione di “chicchi multipli”, spesso fusi insieme.
- Alterazioni della crescita: Le piante mutanti erano generalmente più basse (semi-nane), fiorivano prima del normale, ma producevano meno spighette totali e chicchi più piccoli e leggeri.
Questi fenotipi ci hanno confermato il ruolo cruciale di HvCLV1 e HvFCP1: sono dei “freni” molecolari che dicono al meristema dell’infiorescenza e alla rachilla quando è ora di smettere di proliferare e di differenziarsi correttamente. Senza questi freni, la crescita diventa meno controllata.

Come Funziona il Meccanismo? Uno Sguardo più da Vicino
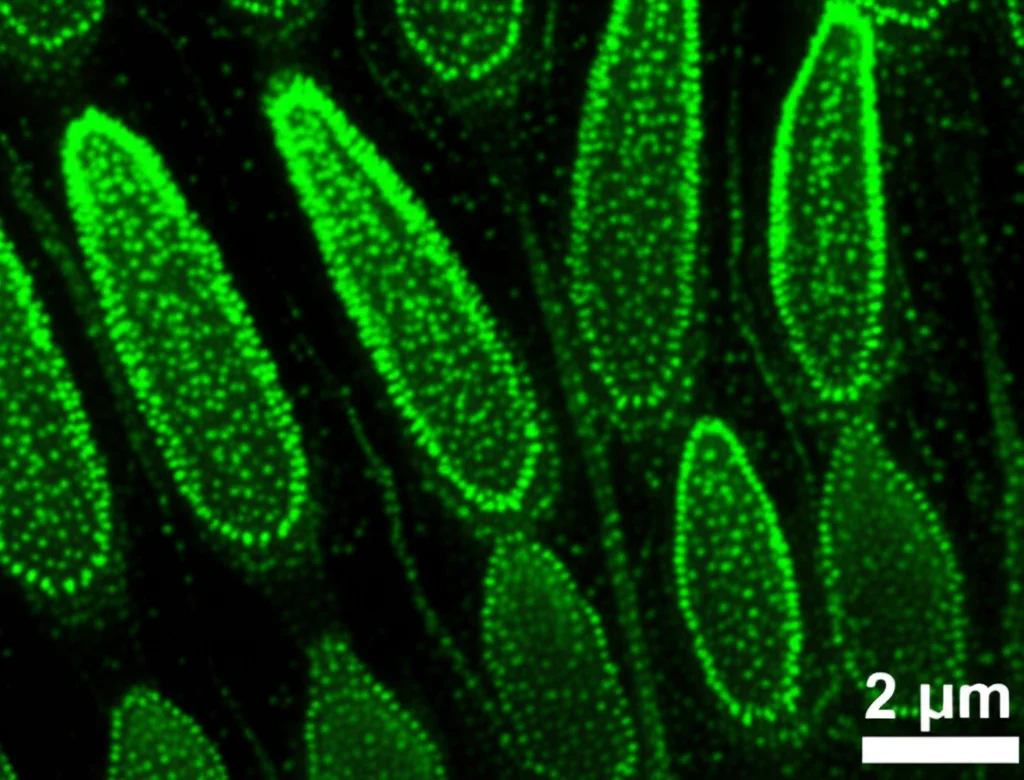
Andando più a fondo, abbiamo cercato di capire *come* questo sistema di segnalazione esercitasse il suo controllo. Abbiamo utilizzato tecniche avanzate come la microscopia confocale per visualizzare dove questi geni sono attivi e dove si localizzano le proteine all’interno dei tessuti in via di sviluppo.
Abbiamo visto che HvCLV1 è espresso in modo abbastanza ampio nei meristemi e nelle varie parti della spighetta in formazione. Invece, HvFCP1 ha un’espressione più specifica, concentrata in particolari zone del meristema apicale, del meristema dell’infiorescenza e, in modo interessante, proprio nella rachilla. Questa localizzazione mirata suggerisce che HvFCP1 agisca come un segnale preciso in punti strategici.
Un dettaglio affascinante è stata l’osservazione dell’internalizzazione della proteina HvCLV1. Quando un recettore come HvCLV1 lega il suo segnale (come HvFCP1), spesso viene internalizzato nella cellula, un po’ come per “spegnere” temporaneamente il segnale o per riciclarlo. Abbiamo notato che questa internalizzazione era particolarmente evidente nelle cellule della rachilla nelle piante normali, ma molto ridotta nelle piante mutanti per Hvfcp1. Questo non solo conferma l’interazione tra i due, ma suggerisce anche che forse altri peptidi simili a HvFCP1 potrebbero parzialmente compensare la sua assenza, spiegando perché i mutanti Hvfcp1 avessero sintomi leggermente meno gravi dei mutanti Hvclv1.
Il Legame con il Metabolismo dello Zucchero: Il Ruolo del T6P
Ma come fa esattamente la segnalazione CLAVATA a coordinare tutto questo? Una scoperta chiave è stata il collegamento con i livelli di trealosio-6-fosfato (T6P). Il T6P è una molecola di zucchero fosforilato che agisce come un importante sensore dello stato energetico della pianta e come regolatore della crescita e dello sviluppo, inclusa la fioritura e la ramificazione.
Analizzando l’espressione genica nelle piante mutanti (tramite RNA-sequencing), abbiamo notato che geni coinvolti nel metabolismo del T6P erano alterati. In particolare, un gene che produce T6P (HvTPS1) era più attivo, mentre un gene che lo degrada (HvSRA, simile al famoso RAMOSA3 del mais) era meno attivo. Questo suggerisce che nei mutanti ci sia un accumulo di T6P nei meristemi “ribelli”. Livelli elevati di T6P sono stati collegati in altre specie proprio a una maggiore ramificazione e a una crescita indeterminata, esattamente quello che osservavamo nelle rachille dei nostri mutanti!
Inoltre, abbiamo visto cambiamenti nell’espressione di geni legati al trasporto degli zuccheri (come HvSWEET11b) e alla regolazione della fioritura e dell’identità delle spighette (come HvFT2). Sembra quindi che la via CLAVATA, agendo sui livelli di T6P, influenzi non solo la proliferazione cellulare ma anche come la pianta distribuisce le sue risorse energetiche (zuccheri) e come regola i tempi del suo sviluppo. È un sistema di controllo incredibilmente integrato!
Perché Tutto Questo è Importante? Implicazioni Future
Capire i meccanismi molecolari che controllano l’architettura dell’infiorescenza nell’orzo non è solo affascinante dal punto di vista della biologia fondamentale, ma ha anche enormi potenzialità pratiche. L’orzo è una coltura fondamentale per l’alimentazione umana (pensate alla birra, al whisky, ma anche a farine e mangimi) e la resa in granella dipende strettamente da come è strutturata la spiga: numero di spighette, numero di fiori fertili per spighetta, dimensione dei chicchi.
I nostri risultati delineano un percorso per “ingegnerizzare” l’architettura della spiga. Modulando specificamente l’attività di geni come HvCLV1 o HvFCP1, o agendo sui livelli di T6P in specifici tessuti meristematici, potremmo essere in grado di:
- Ottimizzare il numero di chicchi per spiga.
- Controllare la dimensione della spiga.
- Influenzare i tempi di fioritura.
- Potenzialmente creare nuove forme di spiga più adatte a determinati ambienti o esigenze agricole.
La grande diversità di forme di infiorescenza che si è evoluta nelle graminacee ci suggerisce che c’è un potenziale genetico nascosto enorme, che potremmo imparare a sfruttare per migliorare le nostre colture. La via CLAVATA sembra essere una delle chiavi per sbloccare questo potenziale.
Insomma, la prossima volta che ammirerete un campo d’orzo dorato, pensate a quella complessa danza molecolare che avviene all’interno di ogni singola pianta, diretta da orchestratori come HvCLV1 e HvFCP1, per dare forma a quelle magnifiche spighe. La natura non smette mai di stupirci con la sua ingegnosità!
Fonte: Springer