Mitocondri Sotto Stress: Abbiamo Trovato l’Interruttore Segreto (e Come Spegnerlo!)
Amici della scienza e curiosi di ogni sorta, mettetevi comodi perché oggi vi porto nel cuore pulsante delle nostre cellule, nei mitocondri! Sì, proprio quelle fantastiche centrali energetiche che ci tengono in vita. Ma cosa succede quando queste centrali vanno in tilt a causa dello stress ossidativo? Beh, la situazione può diventare complicata, portando a una frammentazione eccessiva dei mitocondri e a un loro cattivo funzionamento. Al centro di questo pasticcio c’è spesso una proteina chiamata Fis1, che, in combutta con un’altra proteina, Drp1, orchestra questa dannosa divisione mitocondriale. La domanda che ci siamo posti è stata: come fa Fis1 a “capire” che c’è stress ossidativo e cosa la spinge ad attivarsi in modo così problematico?
Fis1: una proteina con un segreto ben custodito
Pensate a Fis1 come a una proteina con un interruttore. Normalmente, una parte di Fis1, un’elica chiamata α1, si ripiega su se stessa, tenendo nascosta una regione cruciale. È una sorta di auto-inibizione, un meccanismo di sicurezza. Studi precedenti, anche sui lieviti (i cugini unicellulari con cui condividiamo sorprendentemente molta biologia), avevano suggerito che questa regione N-terminale fosse importante. Ma nel nostro caso, nei mammiferi, il ruolo di questa elica α1 sembrava ancora più sfumato e fondamentale per la sua attivazione in condizioni patologiche.
Abbiamo scoperto che quando la cellula è sotto stress, ad esempio a causa di fosforilazioni (l’aggiunta di gruppi fosfato) in punti specifici di Fis1 (come la Thr34 o la Tyr38), questa elica α1 subisce un cambiamento conformazionale. Immaginate che si “sposti”, si apra. Lo abbiamo visto grazie a sofisticate simulazioni al computer (dinamica molecolare, o MD) che ci hanno mostrato come questa elica diventi molto più “ballerina” e instabile dopo la fosforilazione. Non solo, ma quando abbiamo provato a cristallizzare le forme fosforilate (o meglio, mutanti che mimano la fosforilazione) di Fis1 per vederne la struttura ai raggi X, indovinate un po’? L’elica α1 era spesso talmente disordinata da non essere nemmeno visibile nella mappa di densità elettronica! Era la prova che si era effettivamente spostata, lasciando scoperta una parte della proteina prima nascosta.
Cisteina 41: l’eroe inaspettato (o il complice?)
E qui arriva il bello! Questo cambiamento conformazionale espone una cisteina, un amminoacido particolare, precisamente la Cisteina 41 (Cys41). Questa cisteina è l’unica in tutta la proteina Fis1 umana, ed è conservata in molti vertebrati, il che suggerisce un ruolo importante. Le cisteine sono note per essere sensibili all’ambiente redox della cellula, cioè possono “sentire” lo stress ossidativo.
Nelle nostre simulazioni MD, abbiamo visto che la Cys41 diventava molto più accessibile al solvente (cioè all’ambiente circostante) nelle forme “attivate” di Fis1. E quando abbiamo fatto esperimenti biochimici usando una sonda fluorescente che si lega specificamente alle cisteine esposte (la CPM), abbiamo avuto la conferma: nelle forme di Fis1 che mimano la fosforilazione, la Cys41 era decisamente più reattiva, più “a nudo”.
Cosa succede quando questa Cys41 è esposta? Può formare un ponte disolfuro con la Cys41 di un’altra molecola di Fis1. In pratica, due molecole di Fis1 si legano covalentemente, formando un omodimero. E indovinate? Nelle strutture cristalline dei nostri mutanti attivati, abbiamo visto proprio questi dimeri tenuti insieme dal legame tra le due Cys41! Questo dimero di Fis1 sembra essere la forma “cattiva” che recluta massicciamente Drp1 sui mitocondri, scatenando la frammentazione eccessiva. Abbiamo anche notato che questi dimeri espongono delle ampie superfici idrofobiche, perfette per interagire con altre proteine, come Drp1.

A caccia dell’interruttore: la scoperta di SP11
A questo punto, la domanda era ovvia: se la Cys41 esposta e la successiva dimerizzazione sono il problema, possiamo bloccare questo processo? L’idea era di trovare una piccola molecola che si legasse specificamente alla Cys41 della Fis1 *attivata*, quando cioè l’elica α1 si è spostata. Se la Cys41 è nascosta nella Fis1 “normale”, una molecola che la bersaglia non dovrebbe interferire con la sua funzione fisiologica.
Abbiamo quindi messo a punto un saggio di screening: abbiamo usato la nostra Fis1 attivata (il mutante Thr34Asp) e la sonda fluorescente CPM. Se una molecola si lega alla Cys41, la CPM non potrà più legarsi e la fluorescenza diminuirà. Abbiamo testato migliaia di composti e… bingo! Abbiamo trovato una molecola, che abbiamo chiamato SP11.
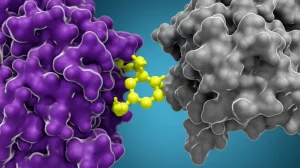
SP11 ha un “cuore” di fenotiazina e una “testa” reattiva (una cloroacetammide) che si lega covalentemente alla Cys41. La cosa interessante è che SP11 non si legava a una versione di Fis1 dove avevamo tolto la Cys41 e ne avevamo messa un’altra esposta in un punto diverso della proteina (il nostro “contro-schermo”). Questo ci ha detto che SP11 era abbastanza selettiva per il sito di legame attorno alla Cys41 originale.
Per essere sicuri al 100%, abbiamo co-cristallizzato SP11 con la nostra Fis1 attivata. La struttura ai raggi X ha confermato tutto: SP11 era lì, legata covalentemente alla Cys41! Non solo, la struttura ci ha mostrato che la parte fenotiazinica di SP11 faceva delle interazioni specifiche con un altro amminoacido, la Tirosina 38 (Tyr38), vicino alla Cys41. Infatti, se mutavamo la Tyr38, SP11 non si legava più, confermando l’importanza di questa interazione per la specificità.
SP11 alla prova del nove: i risultati in laboratorio
Ok, SP11 funziona in provetta, ma nelle cellule? Abbiamo preso delle cellule renali umane (HK-2) e le abbiamo messe sotto stress ossidativo con perossido di idrogeno. Come previsto, i loro mitocondri hanno iniziato a frammentarsi e a produrre più specie reattive dell’ossigeno (ROS), un segno di sofferenza. Ma quando abbiamo trattato le cellule anche con SP11 (a concentrazioni bassissime, nanomolari!), la magia:
- La produzione di ROS mitocondriali è diminuita significativamente.
- La frammentazione mitocondriale è stata prevenuta; i mitocondri rimanevano più integri e allungati.
- Il reclutamento di Drp1 ai mitocondri indotto dallo stress è stato inibito.
La prova del nove definitiva è arrivata da cellule geneticamente modificate (cellule Be(2)-M17 e fibroblasti embrionali di topo, MEF) in cui la Cys41 di Fis1 era stata sostituita con una serina (Cys41Ser), un amminoacido che non può formare ponti disolfuro né legare SP11. In queste cellule Cys41Ser, lo stress da perossido di idrogeno causava molta meno frammentazione mitocondriale e minor produzione di ROS rispetto alle cellule normali. E, cosa cruciale, il trattamento con SP11 non aveva quasi nessun effetto protettivo in queste cellule mutanti! Questo ci ha convinto che l’effetto benefico di SP11 passava proprio attraverso il suo legame con la Cys41 della Fis1.

Oltre la scoperta: cosa significa per il futuro?
Questa scoperta è entusiasmante per diversi motivi. Innanzitutto, abbiamo svelato un meccanismo molecolare dettagliato attraverso cui Fis1 “sente” lo stress ossidativo e si attiva per promuovere la fissione mitocondriale eccessiva. Il ruolo della Cys41 come sensore redox e mediatore della dimerizzazione covalente di Fis1 è una novità importante.
In secondo luogo, abbiamo identificato SP11, un inibitore covalente “first-in-class” che bersaglia specificamente la forma attivata di Fis1. Questo è un passo avanti notevole, perché le proteine di scaffolding come Fis1, che mediano interazioni proteina-proteina e non hanno attività enzimatica classica, sono considerate bersagli farmacologici “difficili”. La nostra strategia di usare la Cys41 esposta come “tallone d’Achille” si è rivelata vincente.
Pensate alle implicazioni: la disfunzione mitocondriale e la frammentazione eccessiva sono coinvolte in una miriade di malattie umane, tra cui malattie neurodegenerative come il Parkinson e l’Huntington, danni da ischemia e riperfusione cardiaca, sepsi e persino la metastasi tumorale. In passato, avevamo già sviluppato un inibitore peptidico (P110) dell’interazione Fis1-Drp1 che si è dimostrato efficace in modelli preclinici. SP11, essendo una piccola molecola, potrebbe offrire vantaggi in termini di somministrazione e biodisponibilità.
Certo, SP11 contiene una fenotiazina, uno scaffold noto per interagire con molti bersagli (polifarmacologia). Tuttavia, l’aggiunta della testa di guerra covalente potrebbe aumentarne la specificità. E in alcune patologie, un po’ di polifarmacologia potrebbe persino essere benefica. Ad esempio, le fenotiazine stesse hanno mostrato effetti positivi in alcune malattie neurodegenerative.
![]()
Il fatto che SP11 sia un inibitore irreversibile e potente suggerisce che potrebbe essere efficace anche a basse dosi, minimizzando potenziali effetti tossici. E la sua specificità per la Cys41 e la Tyr38 di Fis1, come dimostrato dai nostri esperimenti, è un buon punto di partenza per sviluppare futuri farmaci ancora più selettivi.
Insomma, abbiamo aperto una nuova porta sulla comprensione di come i nostri mitocondri rispondono allo stress e, soprattutto, abbiamo trovato una potenziale chiave per proteggerli quando le cose si mettono male. La strada è ancora lunga, ma la speranza di sviluppare nuove terapie per malattie devastanti è un po’ più concreta. E tutto grazie a una cisteina “nascosta” e a una piccola molecola che sa come trovarla!