CIAPIN1: Lo Scudo Segreto dei Reni Contro la Morte Cellulare da Sepsi?
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo delle nostre cellule, in particolare quelle dei reni, i nostri instancabili filtri. Parleremo di una battaglia silenziosa che avviene quando un’infezione grave, la sepsi, colpisce il nostro corpo, mettendo a rischio proprio i reni. Ma non temete, perché sembra esserci un eroe inaspettato in questa storia: una proteina chiamata CIAPIN1. Pronti a scoprire cosa abbiamo svelato?
Un Nemico Insidioso: La Ferroptosi
Prima di presentarvi il nostro potenziale eroe, dobbiamo conoscere il nemico. Non si tratta della solita morte cellulare programmata (apoptosi) di cui forse avete già sentito parlare. No, questa è diversa, più subdola: si chiama ferroptosi. Immaginate una cellula che, letteralmente, arrugginisce dall’interno. È una morte cellulare che dipende dal ferro e da un accumulo eccessivo di “spazzatura” molecolare chiamata specie reattive dell’ossigeno (ROS), che danneggia i grassi delle membrane cellulari (perossidazione lipidica).
Questa ferroptosi ha caratteristiche uniche: la membrana cellulare si rompe, i mitocondri (le centrali energetiche della cellula) si rimpiccioliscono e si danneggiano. Due attori chiave in questo dramma sono le proteine GPX4 e SLC7A11. Quando queste proteine scarseggiano o non funzionano bene, la cellula diventa vulnerabile alla ferroptosi. Questo processo è coinvolto in un sacco di guai, da alcune malattie cardiovascolari fino al cancro, dove, paradossalmente, indurre la ferroptosi potrebbe diventare un’arma terapeutica. Ma cosa c’entra con i reni e la sepsi?
Sepsi, Reni Sotto Attacco e il Mistero di CIAPIN1
La sepsi è una risposta infiammatoria esagerata del corpo a un’infezione. È una condizione gravissima che può portare a insufficienza d’organo, e i reni sono spesso tra le prime vittime, sviluppando quella che chiamiamo insufficienza renale acuta (AKI). Le cellule più delicate del rene, i podociti, che sono fondamentali per la filtrazione del sangue, soffrono particolarmente durante la sepsi.
Nel nostro studio, abbiamo voluto capire meglio cosa succede a livello molecolare. Abbiamo analizzato campioni di sangue di pazienti con sepsi e AKI, pazienti con sepsi ma senza AKI, e persone sane. E qui abbiamo fatto la prima scoperta interessante: i livelli di una proteina chiamata CIAPIN1 nel sangue erano significativamente più bassi nei pazienti con sepsi e danno renale rispetto agli altri gruppi.
CIAPIN1 (sta per Cytokine-induced apoptosis inhibitor 1) è nota per essere una proteina anti-apoptosi, cioè che protegge le cellule dalla morte programmata “classica”, soprattutto quando mancano certi segnali di sopravvivenza (le citochine). Ma il suo ruolo nella ferroptosi era un mistero. Vedere i suoi livelli così bassi proprio quando i reni erano sotto attacco ci ha fatto drizzare le antenne: e se CIAPIN1 avesse un ruolo protettivo anche contro la ferroptosi nei podociti danneggiati dalla sepsi?
Per indagare, abbiamo creato un modello in laboratorio. Abbiamo preso cellule di podociti di topo (chiamate MPC5) e le abbiamo “stressate” con il lipopolisaccaride (LPS), un componente della parete dei batteri Gram-negativi che viene spesso usato per mimare gli effetti della sepsi in provetta. Proprio come nei pazienti, anche nelle cellule trattate con LPS i livelli di CIAPIN1 (sia mRNA che proteina) diminuivano. Era il momento di passare all’azione.
CIAPIN1 alla Riscossa: Più Proteina, Meno Danni!
Cosa succederebbe se aumentassimo artificialmente i livelli di CIAPIN1 in queste cellule stressate? Abbiamo usato una tecnica di ingegneria genetica per “sovraesprimere” CIAPIN1 (abbiamo chiamato questo gruppo OE-CIAPIN1) nei podociti prima di esporli all’LPS. I risultati sono stati elettrizzanti!
Le cellule con più CIAPIN1:
- Sopravvivevano meglio: La proliferazione cellulare aumentava rispetto alle cellule trattate solo con LPS.
- Morivano di meno: L’apoptosi (la morte cellulare programmata) diminuiva drasticamente.
- Mostravano meno segni di danno: Abbiamo guardato i livelli di due proteine marcatrici dello stato di salute dei podociti: la Sinaptopodina (un segno buono) e la Desmina (un segno cattivo, di danno). Ebbene, OE-CIAPIN1 faceva aumentare la Sinaptopodina e diminuire la Desmina! Sembrava proprio che CIAPIN1 stesse proteggendo l’integrità di queste cellule vitali.
Era chiaro che CIAPIN1 stava facendo qualcosa di buono, ma come? Qual era il meccanismo segreto?
Svelare il Trucco: La Via di Segnalazione PI3K/AKT
Nel complesso mondo della comunicazione cellulare, esistono delle “autostrade” di segnali che dicono alla cellula cosa fare: crescere, sopravvivere, morire. Una di queste vie cruciali è la via PI3K/AKT. È fondamentale per la crescita, il metabolismo e la sopravvivenza cellulare. Molti studi l’hanno collegata alla protezione delle cellule renali.
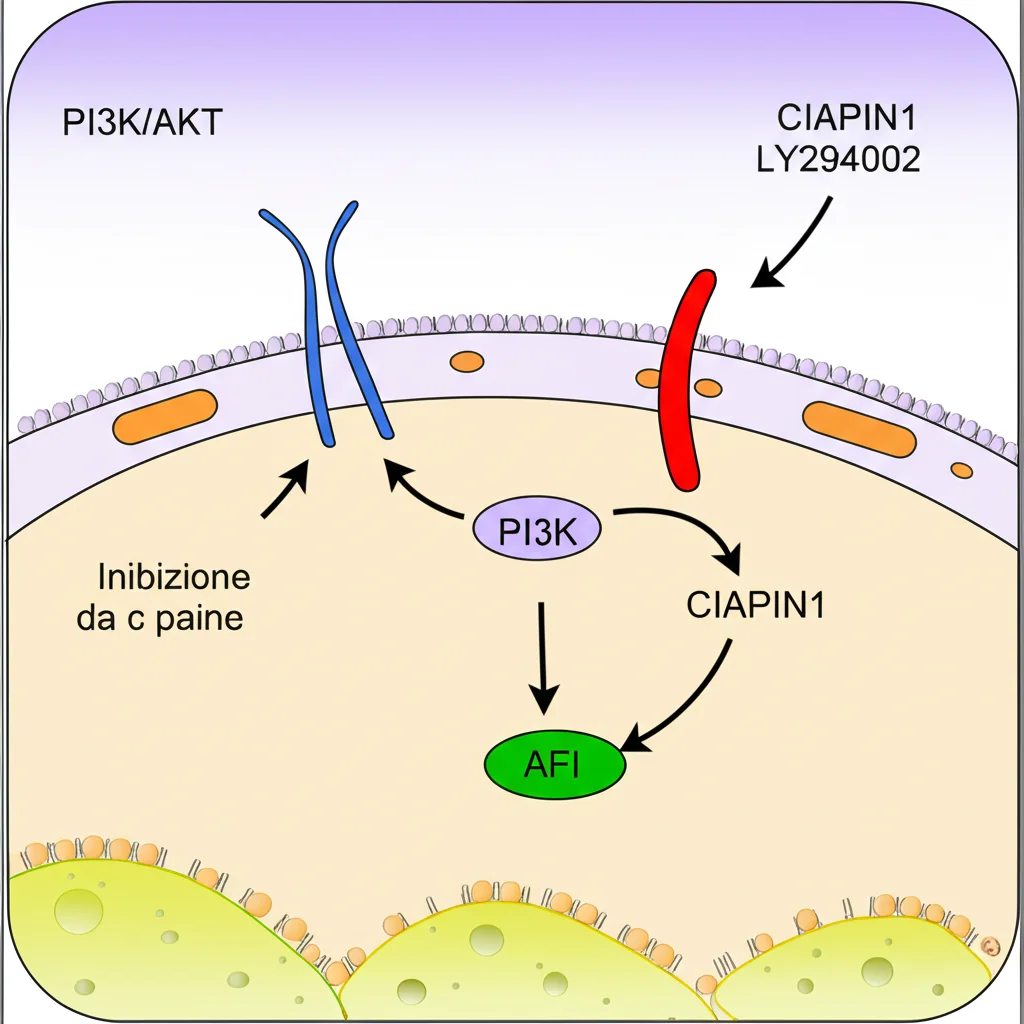
Ci siamo chiesti: CIAPIN1 usa forse questa via per esercitare i suoi effetti protettivi? Abbiamo misurato i livelli di attivazione di questa via (guardando le forme “fosforilate”, cioè attive, di PI3K e AKT) nelle nostre cellule. Bingo! Nelle cellule OE-CIAPIN1 trattate con LPS, i livelli di p-PI3K e p-Akt erano significativamente più alti rispetto alle cellule di controllo trattate con LPS. CIAPIN1 stava chiaramente accendendo questa via di sopravvivenza!
Per avere la prova del nove, abbiamo fatto l’esperimento contrario: abbiamo preso le cellule OE-CIAPIN1 e, oltre all’LPS, le abbiamo trattate con un inibitore specifico della via PI3K/AKT (una molecola chiamata LY294002). Cosa è successo? L’effetto protettivo di CIAPIN1 è svanito! I livelli di Sinaptopodina sono scesi di nuovo e quelli di Desmina sono risaliti. Era la conferma: CIAPIN1 protegge i podociti dal danno indotto da LPS attivando la via PI3K/AKT.
Il Colpo di Grazia alla Ferroptosi
Ma torniamo alla ferroptosi, il nostro “nemico arrugginente”. La via PI3K/AKT è coinvolta anche nella regolazione della ferroptosi? E CIAPIN1, attivando questa via, riesce a contrastarla?
Abbiamo misurato i segni tipici della ferroptosi nelle nostre cellule:
- Stress ossidativo (ROS): Abbiamo usato un colorante (DHE) che diventa fluorescente in presenza di ROS. Le cellule OE-CIAPIN1 avevano molti meno ROS rispetto a quelle trattate solo con LPS. E, di nuovo, l’inibitore LY294002 annullava questo beneficio.
- Danno lipidico (MDA): Il malondialdeide (MDA) è un prodotto della perossidazione lipidica, un marcatore chiave della ferroptosi. OE-CIAPIN1 riduceva i livelli di MDA, ma l’inibitore li faceva risalire.
- Accumulo di Ferro (Fe2+): La ferroptosi dipende dal ferro. OE-CIAPIN1 riduceva la concentrazione di ioni ferrosi (Fe2+) nelle cellule, effetto invertito dall’inibitore.
- Proteine Anti-Ferroptosi (SLC7A11 e GPX4): Ricordate quei due attori chiave che proteggono dalla ferroptosi? Ebbene, OE-CIAPIN1 aumentava i livelli di SLC7A11 e GPX4! E, come ormai avrete intuito, l’inibitore LY294002 riportava i livelli verso il basso.
Il quadro era completo: CIAPIN1, attraverso l’attivazione della via PI3K/AKT, riesce a spegnere la miccia della ferroptosi nei podociti esposti a LPS. Riduce lo stress ossidativo, l’accumulo di ferro e potenzia le difese naturali della cellula contro questo tipo di morte.
Cosa Significa Tutto Questo? Limiti e Prospettive Future
Quindi, riassumendo: abbiamo visto che CIAPIN1 è ridotta nei pazienti con danno renale da sepsi e nei podociti “stressati” in laboratorio. Aumentare i livelli di CIAPIN1 protegge queste cellule dalla morte (sia apoptosi che ferroptosi) e dal danno, attivando la via di sopravvivenza PI3K/AKT. Questo meccanismo sembra cruciale per contrastare specificamente la ferroptosi.
Certo, il nostro è uno studio in vitro (su cellule in coltura) e con un numero limitato di pazienti analizzati. Serviranno ricerche più ampie, magari studi longitudinali sull’uomo e l’uso di inibitori specifici della ferroptosi nei modelli sperimentali per confermare questi risultati e capire se CIAPIN1 possa davvero diventare un bersaglio terapeutico per prevenire o curare l’insufficienza renale acuta nei pazienti con sepsi.
Tuttavia, penso che abbiamo aperto una porta davvero interessante. Capire come le cellule renali si difendono dalla ferroptosi e come possiamo potenziare queste difese potrebbe offrire nuove speranze per combattere una complicanza così grave della sepsi. Il nostro piccolo eroe, CIAPIN1, potrebbe avere un ruolo da protagonista in futuro! Continueremo a indagare, perché svelare i segreti delle nostre cellule è la chiave per trovare nuove cure.

Fonte: Springer