Cell Painting PLUS: Dipingiamo le Cellule con Più Colori e Dettagli Mai Visti Prima!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona tantissimo nel mio campo: guardare dentro le cellule. Non è fantascienza, ma quasi! Usiamo tecniche di imaging avanzate per capire come funzionano le cellule, cosa succede quando si ammalano o quando le trattiamo con farmaci o altre sostanze. Immaginate di poter “dipingere” le diverse parti di una cellula con colori fluorescenti per vederle meglio al microscopio. Ecco, questa è l’idea alla base di una tecnica chiamata Cell Painting (CP).
Cos’è il Cell Painting (e perché è già forte)?
Il Cell Painting è un metodo potentissimo che ci permette di colorare contemporaneamente diverse strutture all’interno delle cellule: il DNA nel nucleo, l’RNA nel citoplasma, i mitocondri (le centrali energetiche), il reticolo endoplasmatico, l’apparato del Golgi, i filamenti di actina (che danno forma alla cellula) e la membrana esterna. Usando un set specifico di coloranti fluorescenti e microscopi high-tech, otteniamo immagini spettacolari.
Ma non è solo una questione estetica! Analizzando queste immagini con software intelligenti, possiamo estrarre centinaia, a volte migliaia, di caratteristiche quantitative per ogni singola cellula: dimensioni, forma, intensità dei colori, texture… un vero e proprio “profilo morfologico”. La cosa fantastica è che cellule trattate con sostanze che hanno un meccanismo d’azione (MoA) simile tendono ad avere profili simili. Questo ci aiuta a scoprire come agisce un nuovo farmaco, a identificare sostanze potenzialmente tossiche o a capire meglio le basi di una malattia. Il CP è già stato usato in progetti enormi, come quello per creare profili di migliaia di composti chimici industriali o farmaceutici, rendendo i dati accessibili a tutta la comunità scientifica.
I Limiti del “Quadro” Originale
Per quanto potente sia, il Cell Painting standard ha qualche limite. È stato pensato per essere super efficiente in termini di costi e tempi, usando un set fisso di coloranti e acquisendo le immagini in pochi canali del microscopio (di solito 4 o 5). Per massimizzare l’efficienza, spesso i segnali di due coloranti diversi vengono acquisiti nello stesso canale (ad esempio, RNA insieme al Reticolo Endoplasmatico, o Actina insieme al Golgi). Questo è un compromesso: si ottengono tanti dati velocemente, ma si perde un po’ di specificità. È come se, dipingendo, mescolassimo due colori nello stesso barattolo: il risultato è unico, ma non riusciamo più a distinguere perfettamente i due colori originali. Inoltre, la standardizzazione ha portato a usare principalmente pochi tipi cellulari e in condizioni non sempre vicine a quelle fisiologiche reali.
Ecco a Voi: Cell Painting PLUS (CPP)!
Ed è qui che entra in gioco la novità di cui voglio parlarvi: il Cell Painting PLUS (CPP)! Abbiamo sviluppato questo approccio per superare alcuni dei limiti del CP originale e offrire ancora più opzioni per le nostre ricerche. L’idea chiave del CPP è un ciclo iterativo di colorazione-eluzione. Cosa significa? Semplice:
- Coloriamo le cellule con un primo set di coloranti fluorescenti (ad esempio, per i lisosomi, i mitocondri, l’actina e l’RNA).
- Acquisiamo le immagini al microscopio.
- Usiamo uno speciale “buffer di eluzione” che abbiamo ottimizzato per “lavare via” i coloranti senza danneggiare la struttura della cellula. È come cancellare una parte del disegno per far spazio a nuovi dettagli!
- Coloriamo di nuovo le stesse cellule con un secondo set di coloranti (ad esempio, per il DNA, il Golgi e il Reticolo Endoplasmatico).
- Acquisiamo nuove immagini.
Questo processo ci permette di usare più coloranti (nel nostro studio, almeno 7 coloranti per visualizzare 9 compartimenti diversi, aggiungendo i lisosomi!) e, soprattutto, di acquisire ogni colorante in un canale separato. Niente più segnali mescolati!
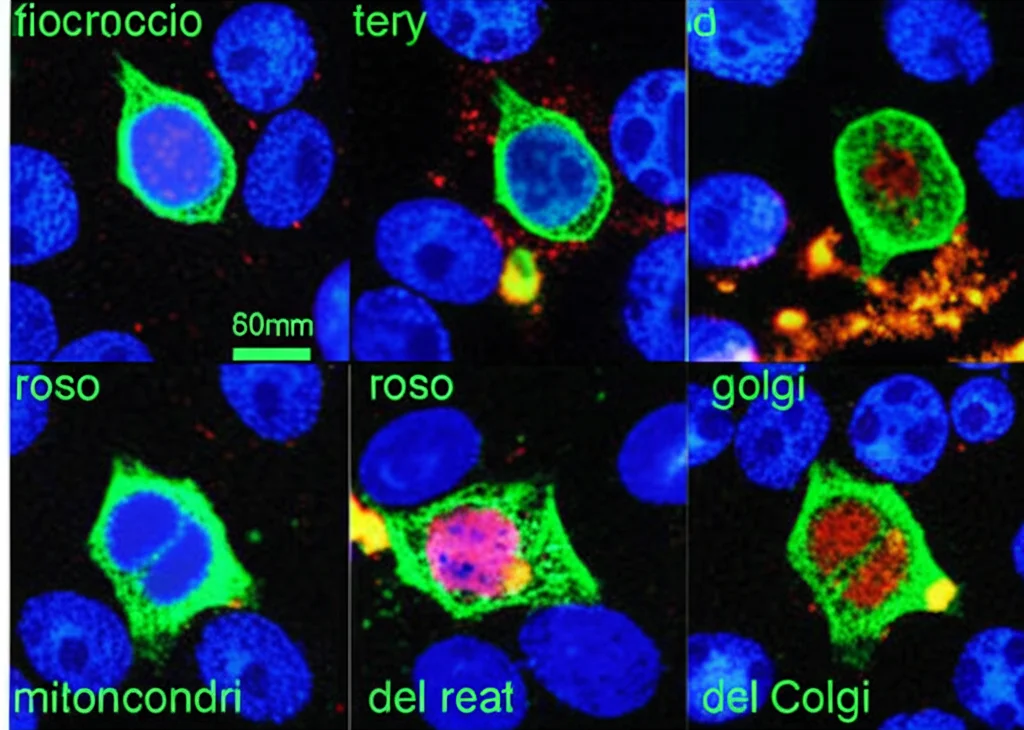
I Vantaggi del “PLUS”
Quali sono i benefici concreti del CPP?
- Maggiore Flessibilità e Personalizzazione: Possiamo scegliere e combinare diversi coloranti in base alla domanda specifica della nostra ricerca. Non siamo legati al set fisso del CP. Possiamo anche usare anticorpi specifici!
- Profili Più Specifici e Diversificati: Acquisendo ogni colorante separatamente, otteniamo profili morfologici più “puliti” e specifici per ogni organello. Questo ci dà informazioni più precise sui processi cellulari e su come vengono perturbati. Ad esempio, possiamo distinguere chiaramente un effetto sull’Actina da uno sul Golgi.
- Aggiunta di Nuovi Biomarcatori: Abbiamo incluso i lisosomi, organelli cruciali per il riciclo cellulare e lo stress, e abbiamo migliorato l’analisi dei nucleoli (strutture dentro il nucleo importanti per la produzione di ribosomi e sensibili allo stress cellulare).
- Applicabilità Ampia: Abbiamo testato il CPP con successo su diverse linee cellulari umane: cellule di cancro al seno (MCF-7), osteosarcoma (U2OS), carcinoma epatico (HepG2) e persino cellule primarie di rene (RPTEC), dimostrando che funziona bene in contesti biologici diversi e anche in condizioni di coltura più fisiologiche (cellule confluenti).
Come Funziona l’Eluzione?
Lo so, vi starete chiedendo: “Ma come fate a lavare via i coloranti senza rovinare tutto?”. È stata una bella sfida! Abbiamo testato diverse combinazioni di buffer (variando pH, agenti riducenti, forza ionica, temperatura, tempi) per trovare la ricetta ottimale. Il nostro buffer di eluzione CPP (basato su L-Glicina e SDS a pH acido) è molto efficace nel rimuovere quasi tutti i coloranti, preservando la morfologia cellulare. Curiosamente, abbiamo fatto in modo che non rimuovesse completamente il colorante dei mitocondri. Perché? Perché così possiamo usare il segnale residuo dei mitocondri come punto di riferimento per allineare perfettamente le immagini del primo e del secondo ciclo di colorazione. Ingegnoso, no? Abbiamo anche verificato che, dopo l’eluzione, potevamo ricolorare le cellule con gli stessi coloranti (tranne quelli per cellule vive e, stranamente, l’actina con falloidina) ottenendo segnali e morfologie comparabili.
CPP vs CP: Un Confronto Diretto
Per capire davvero il valore aggiunto del CPP, lo abbiamo confrontato direttamente con il CP standard. Abbiamo usato una piastra con 15 composti di riferimento (farmaci, tossine, sostanze chimiche con meccanismi d’azione noti) e li abbiamo testati su cellule MCF-7 con entrambe le tecniche. Abbiamo poi analizzato le migliaia di immagini generate usando sia software commerciali (Harmony) che open-source (Cell Profiler) per estrarre i profili morfologici.
I risultati? In generale, i profili ottenuti con CPP e CP erano coerenti per gli organelli comuni (come DNA e mitocondri). Tuttavia, il CPP ha mostrato la sua forza nei casi in cui il CP mescolava i segnali. Ad esempio, per un composto chiamato Tetrandrina, il CP mostrava effetti sui canali “misti” RNA/ER e Actina/Golgi. Con il CPP, siamo riusciti a vedere che l’effetto era più specificamente sul Reticolo Endoplasmatico (ER) e sul Golgi, separatamente dall’RNA e dall’Actina. Questa maggiore specificità è fondamentale per capire meglio cosa sta succedendo nella cellula. Abbiamo anche valutato la robustezza e la riproducibilità del CPP, ottenendo risultati ottimi, comparabili o persino migliori di quelli del CP, anche usando diverse magnificazioni (20x e 40x).
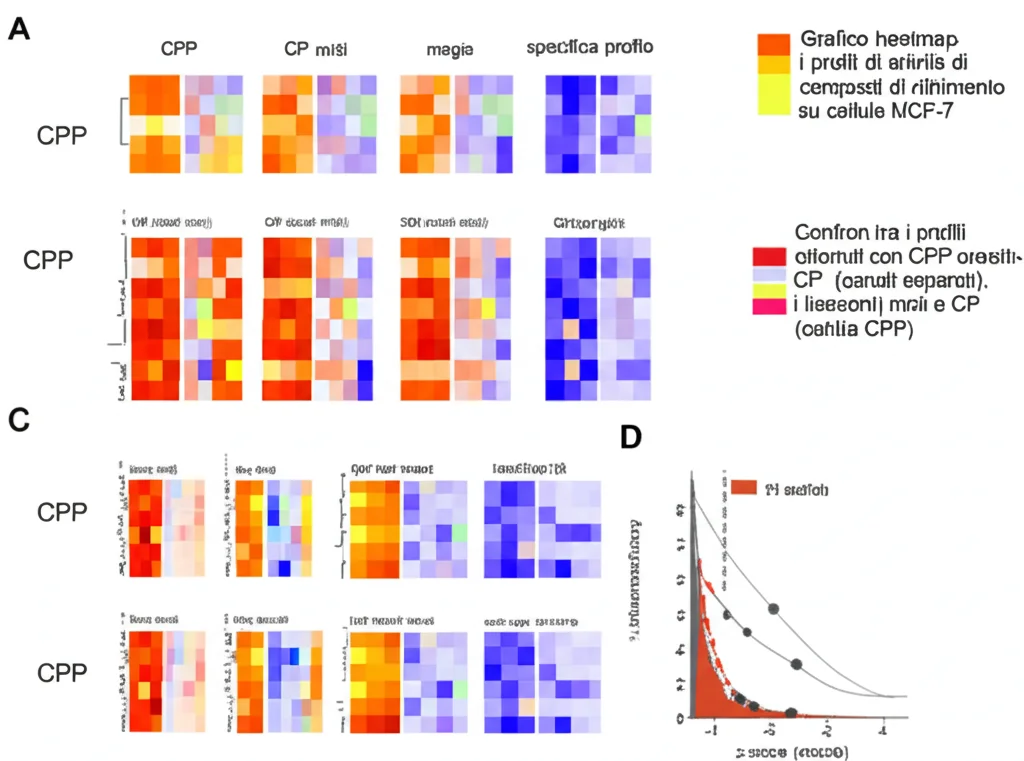
Approfondimenti Specifici: I Casi Studio
Per illustrare ancora meglio le potenzialità del CPP, abbiamo analizzato alcuni esempi specifici.
1. Focus sui Nucleoli: I nucleoli sono piccole strutture nel nucleo, essenziali per produrre ribosomi e sensibili allo stress cellulare. Cambiamenti nel loro numero o forma sono legati a cancro e altre malattie. Li abbiamo analizzati come compartimento distinto. Con il CPP, abbiamo visto chiaramente come farmaci come la Rapamicina (un inibitore di mTOR) riducessero il numero di nucleoli in alcune linee cellulari, confermando il legame tra mTOR e biogenesi dei ribosomi. Altri composti, come la Latrunculina B (che distrugge il citoscheletro di actina) o il Rotenone (un inibitore mitocondriale che genera stress ossidativo), causavano anch’essi cambiamenti specifici nei nucleoli, dimostrando come il CPP possa svelare connessioni funzionali tra diversi processi cellulari.
2. Districare Actina e Golgi: Nel CP standard, Actina e Golgi sono spesso nello stesso canale. Abbiamo testato due tossine che colpiscono l’actina, la Citocalasina D e la Latrunculina B. Entrambe distruggono i filamenti di actina e, di conseguenza, alterano anche la struttura del Golgi. Con il CPP, acquisendo i segnali separatamente, abbiamo potuto osservare qualcosa di interessante con la Citocalasina D: gli effetti sull’actina avvenivano a concentrazioni più basse rispetto a quelli sul Golgi. Questo suggerisce una sequenza di eventi: prima viene perturbata l’actina (effetto primario), e solo a concentrazioni maggiori si vedono le conseguenze sul Golgi (effetto secondario). Questa distinzione era impossibile con il CP standard. Abbiamo anche usato analisi di correlazione per confrontare i profili globali dei composti. È emerso che, separando Actina e Golgi, il profilo della Citocalasina D in CPP diventava più unico e distinto rispetto a quello della Latrunculina B e di altri composti, suggerendo che la separazione dei canali migliora la capacità di raggruppare composti con MoA simili o di distinguere quelli con effetti più sottili.
3. Luce sui Lisosomi: I lisosomi sono gli “inceneritori” e centri di riciclo della cellula. Li abbiamo aggiunti nel CPP. Abbiamo testato composti noti per interagire con i lisosomi (Siramesina, Flufenazina, Tetrandrina). Il CPP ha mostrato chiaramente gli effetti su questi organelli (aggregazione, cambiamenti di texture). Analizzando la somiglianza dei profili, questi tre composti formavano un cluster ben definito, confermando il loro MoA comune legato ai lisosomi. Interessante è stato notare che anche un farmaco antitumorale, il Sunitinib Malato, mostrava un profilo simile e si univa a questo cluster solo quando includevamo le caratteristiche dei lisosomi nell’analisi CPP. Questo suggerisce un effetto secondario del Sunitinib sui lisosomi, cosa confermata da altri studi. Ancora una volta, la capacità del CPP di separare i canali ER e Golgi (mescolati nel CP) ha permesso di caratterizzare meglio gli effetti secondari di questi composti lisosomotropici su altri organelli.
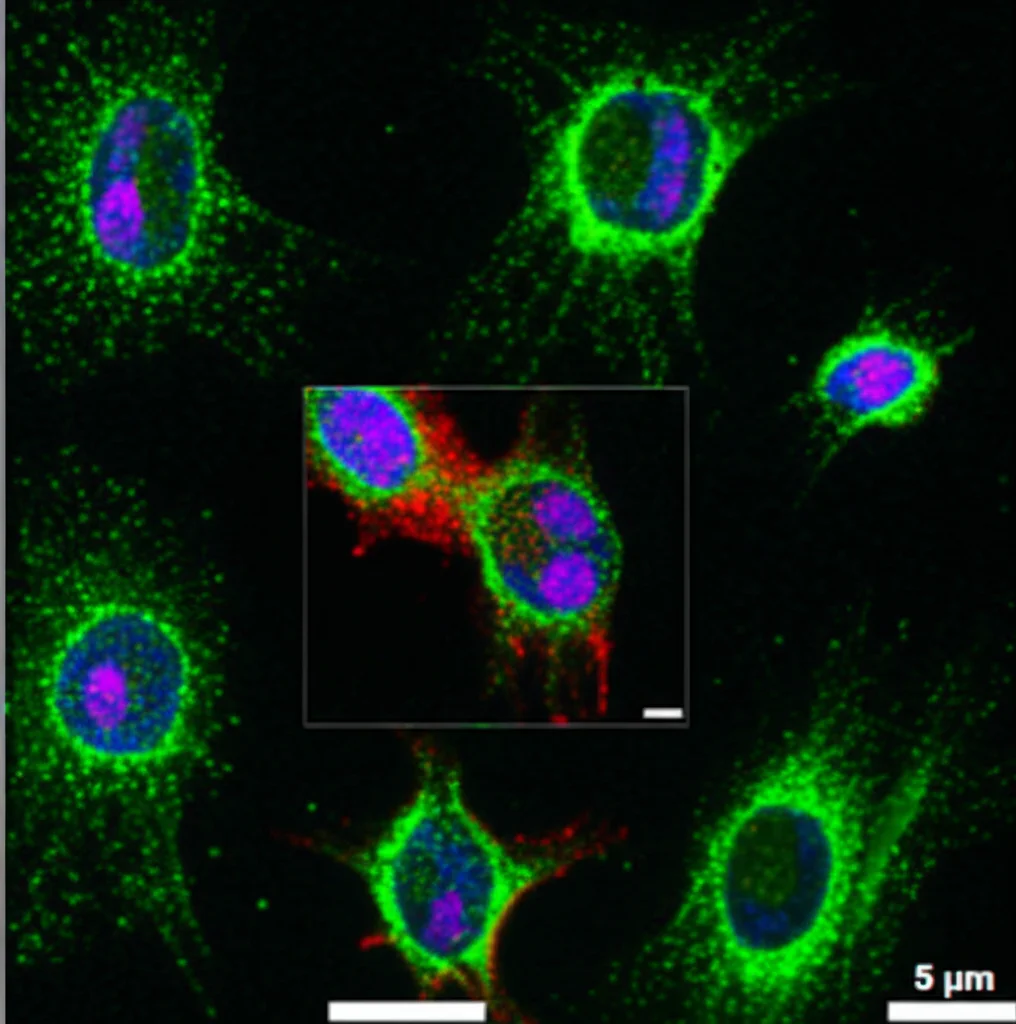
CPP: Uno Strumento in Più nella Cassetta degli Attrezzi
Quindi, il Cell Painting PLUS è il sostituto definitivo del Cell Painting? Non necessariamente. Lo vedo più come un’evoluzione, uno strumento complementare. Il CPP offre una flessibilità e una specificità maggiori, ideali per domande di ricerca più mirate o quando si lavora con modelli cellulari complessi, preziosi o difficili da ottenere (come cellule derivate da pazienti o da iPSC). Permette di scavare più a fondo nei meccanismi d’azione.
Certo, c’è un compromesso. Il processo iterativo richiede più tempo, più reagenti (anche se il costo per singolo colorante è simile al CP) e genera più dati da archiviare e analizzare. La capacità di screening ad altissimo volume (throughput) è inferiore a quella del CP standard. La scelta tra CP e CPP dipenderà quindi dagli obiettivi specifici dello studio, dalle risorse disponibili e dal livello di dettaglio richiesto. Se serve uno screening primario rapidissimo su migliaia di composti, il CP resta forse imbattibile. Se invece si vuole fare uno studio secondario più approfondito, caratterizzare finemente il MoA o lavorare su modelli particolari, il CPP offre vantaggi significativi.
Verso il Futuro: Cosa Ci Aspetta?
Sono davvero entusiasta delle prospettive future del CPP. Stiamo già iniziando ad applicarlo in progetti più ampi, ad esempio per studiare la tossicità di composti chimici e capire meglio i meccanismi che portano a danni cellulari. L’idea è di usare i profili morfologici dettagliati generati dal CPP come input per algoritmi di machine learning e deep learning. Questo potrebbe aiutarci a:
- Predire il meccanismo d’azione di nuovi composti confrontando i loro profili con quelli di composti noti o di perturbazioni genetiche.
- Collegare la struttura chimica di una molecola al suo effetto biologico (relazioni struttura-attività).
- Integrare i dati di imaging con altri dati ‘omici (trascrittomica, proteomica, metabolomica) per una visione ancora più completa della biologia cellulare.
- Contribuire allo sviluppo di “New Approach Methodologies” (NAMs) per la valutazione della sicurezza chimica, riducendo la necessità di test su animali.
In conclusione, il Cell Painting PLUS rappresenta un passo avanti significativo nel campo dell’imaging cellulare ad alto contenuto informativo. Combinando l’efficienza della colorazione con coloranti con la potenza del multiplexing iterativo, ci offre una finestra ancora più chiara e dettagliata sul mondo affascinante all’interno delle nostre cellule. È uno strumento potente che, sono sicuro, ci aiuterà a fare nuove scoperte in biologia, nella ricerca di farmaci e nella tossicologia. Non vedo l’ora di vedere cosa riusciremo a “dipingere” dopo!
Fonte: Springer







