CD109: Il Regista Occulto che Potenzia i Tumori Squamosi via IL-6? Scopriamo Come!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore della ricerca sul cancro, un campo dove ogni scoperta, anche la più piccola, può accendere una speranza. Parliamo di un tipo di tumore piuttosto comune, il carcinoma a cellule squamose (SCC), che purtroppo può essere ostico da trattare, soprattutto quando tende a ripresentarsi o a diffondersi (metastasi).
Da tempo si sospetta che una molecola infiammatoria, chiamata interleuchina-6 (IL-6), giochi un ruolo importante nello sviluppo di questo tumore. Ma come agisce esattamente? I meccanismi precisi sono ancora un po’ un mistero. Ed è qui che entra in gioco un’altra proteina, un po’ meno conosciuta ma non per questo meno importante: la CD109.
Chi è questa CD109 e perché ci interessa?
Pensate alla CD109 come a una proteina che si trova sulla superficie delle nostre cellule. Studi recenti hanno notato che è spesso presente in quantità eccessive nelle cellule del carcinoma squamoso, che sia della pelle, della bocca, dei polmoni o di altre zone. Addirittura, sembra che la sua presenza abbondante possa essere un segnale di allarme per una maggiore aggressività del tumore e un rischio più alto di metastasi.
Inizialmente, la CD109 era nota per essere una specie di “freno” per un’altra molecola importante, il TGF-β, che è coinvolto in processi come la fibrosi. Quindi, vederla così attiva nei tumori è stato un po’ un paradosso. Questo ci ha spinto a chiederci: cosa combina davvero la CD109 nel contesto del carcinoma squamoso? Non è che, oltre a regolare il TGF-β, interagisce anche con altri “attori” sulla scena tumorale?
L’ipotesi intrigante: CD109 e IL-6 fanno squadra?
Ecco l’idea che ha guidato una recente ricerca: e se la CD109 collaborasse proprio con il sistema dell’IL-6 per favorire la crescita del tumore? L’IL-6, per agire, ha bisogno di legarsi a un suo specifico recettore sulla superficie cellulare, chiamato IL-6Rα (recettore alfa dell’IL-6). La domanda è diventata: la CD109 interagisce forse con questo recettore IL-6Rα? E se sì, cosa comporta questa interazione?
Per scoprirlo, i ricercatori si sono messi al lavoro usando cellule di carcinoma squamoso umano (sia orale che vulvare) coltivate in laboratorio e analizzando anche campioni di tumori reali prelevati da pazienti, confrontandoli con tessuto sano.
La scoperta: un’alleanza molecolare inaspettata
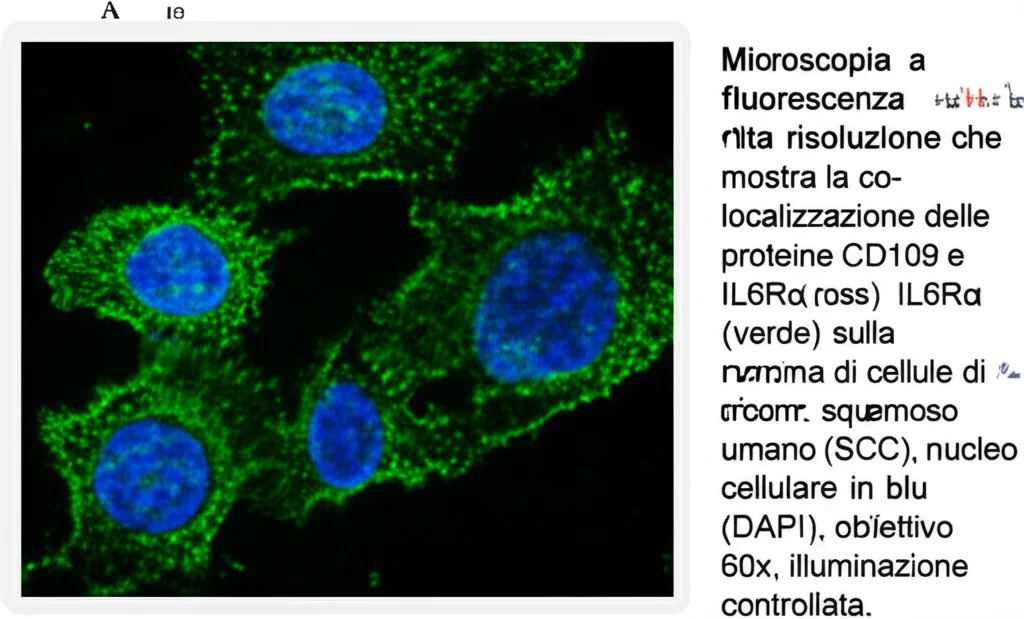
Ebbene sì, i risultati sono stati sorprendenti! Attraverso tecniche sofisticate come la co-immunoprecipitazione (che permette di vedere se due proteine si “agganciano” tra loro) e l’analisi al microscopio (immunofluorescenza e immunoistochimica), è emerso chiaramente che la CD109 e il recettore IL-6Rα interagiscono fisicamente. Non solo: sembrano proprio “piacersi”, visto che si trovano spesso insieme sulla superficie delle cellule tumorali, sia in laboratorio che nei tumori dei pazienti.
Ma la cosa ancora più interessante è il *perché* di questa interazione. Sembra che la CD109 agisca come una sorta di “stabilizzatore” per IL-6Rα. In pratica, legandosi a IL-6Rα, la CD109 impedisce che venga degradato troppo in fretta dalla cellula. Il risultato? Più recettori IL-6Rα rimangono disponibili sulla superficie cellulare, pronti a catturare l’IL-6 circolante.
La catena di comando: STAT3 e NRF2 entrano in scena
Ok, abbiamo più recettori IL-6Rα stabilizzati dalla CD109. E quindi? Quando l’IL-6 si lega a questi recettori potenziati, il segnale che invia all’interno della cellula diventa molto più forte. Questo segnale attiva una via di comunicazione intracellulare cruciale, nota come via STAT3. STAT3 è un fattore di trascrizione, cioè una proteina che va nel nucleo della cellula e “accende” o “spegne” specifici geni.
Ma non finisce qui. L’attivazione di STAT3, a sua volta, sembra dare il via a un altro attore importante: NRF2. NRF2 è il “capo” delle difese antiossidanti della cellula. Il suo compito è proteggere la cellula dallo stress ossidativo, attivando geni che producono enzimi antiossidanti come la superossido dismutasi 1 (SOD1) e l’eme ossigenasi-1 (HO1).
Quindi, ricapitolando la catena:
- CD109 stabilizza IL-6Rα.
- Più IL-6Rα significa una risposta più forte all’IL-6.
- La risposta forte all’IL-6 attiva potentemente STAT3.
- STAT3 attivato promuove l’attività di NRF2.
- NRF2 potenzia le difese antiossidanti (SOD1, HO1).
Le conseguenze: cellule tumorali più “toste” e resistenti
Questa cascata di eventi ha due conseguenze principali, entrambe vantaggiose per il tumore e svantaggiose per noi:
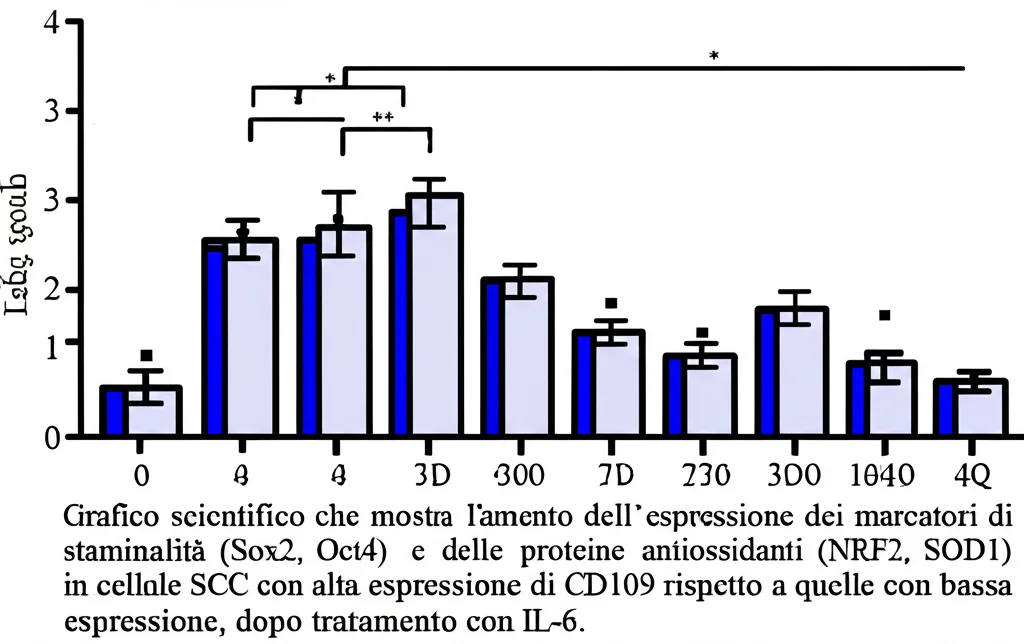
1. Aumento della “Stemness”: L’attivazione della via IL-6/STAT3 è nota per conferire alle cellule tumorali caratteristiche simili a quelle delle cellule staminali (la cosiddetta “stemness”). Queste cellule “staminali tumorali” sono particolarmente pericolose perché sono più resistenti alle terapie, possono dare origine a nuove cellule tumorali e sono spesso responsabili delle recidive e delle metastasi. Lo studio ha confermato che le cellule con più CD109 mostravano più marcatori di staminalità (come Sox2, Oct4, Nanog) e formavano più “sfere tumorali” (un test di laboratorio che simula la crescita tumorale) in risposta all’IL-6. Togliendo la CD109, questo effetto si riduceva drasticamente.
2. Potenziamento dello stato antiossidante: L’attivazione di NRF2 e dei suoi geni bersaglio (SOD1, HO1) rende le cellule tumorali più brave a gestire lo stress ossidativo. Questo è un vantaggio enorme per loro, perché molte chemioterapie e radioterapie funzionano proprio inducendo stress ossidativo per uccidere le cellule cancerose. Cellule con alte difese antiossidanti sono, quindi, più resistenti a questi trattamenti. Lo studio ha mostrato che le cellule senza CD109 avevano livelli più bassi di NRF2, SOD1 e HO1 e livelli più alti di specie reattive dell’ossigeno (ROS, un indicatore di stress ossidativo), soprattutto dopo stimolazione con IL-6.
Dalla provetta al paziente: le conferme cliniche
Tutto molto interessante in laboratorio, ma questi meccanismi si verificano anche nei pazienti reali? Per rispondere, i ricercatori hanno analizzato campioni di tumori della bocca (carcinoma squamoso orale) prelevati durante interventi chirurgici. Hanno scoperto che, rispetto al tessuto sano adiacente, i tumori avevano livelli molto più alti di CD109, IL-6Rα, STAT3 attivato (fosforilato) e NRF2. E, cosa fondamentale, c’era una correlazione positiva: più CD109 c’era, più alti erano anche i livelli degli altri componenti di questa “via”.
Hanno poi allargato l’analisi, usando database pubblici (come LinkedOmics e TCGA/cBioPortal) che raccolgono dati genomici e proteomici da centinaia di pazienti con tumori della testa e del collo (HNSCC, che includono quelli orali). Anche qui, le analisi hanno confermato una forte correlazione tra alti livelli di CD109 e alti livelli di NRF2 (sia come proteina che come attivazione della sua via) e tra CD109 e IL-6Rα a livello di mRNA.
Infine, un dato clinico preoccupante: analizzando i dati di sopravvivenza di oltre 500 pazienti, è emerso che quelli con tumori che esprimevano alti livelli sia di CD109 che di IL-6Rα avevano una prognosi peggiore, sia in termini di sopravvivenza generale che di tempo senza ricaduta della malattia.
Cosa ci portiamo a casa da questa scoperta?
Questa ricerca svela un meccanismo nuovo e importante attraverso cui la proteina CD109 promuove l’aggressività del carcinoma a cellule squamose. Agendo come uno stabilizzatore per il recettore IL-6Rα, la CD109 amplifica la segnalazione dell’IL-6, attivando la cascata STAT3/NRF2. Questo porta a cellule tumorali con maggiori capacità staminali e difese antiossidanti potenziate, rendendole più resistenti alle terapie e più inclini a dare metastasi.
È una scoperta affascinante perché identifica un asse molecolare specifico (CD109/IL-6Rα/STAT3/NRF2) come un potenziale bersaglio terapeutico. Immaginate di poter bloccare l’interazione tra CD109 e IL-6Rα, o di inibire uno degli anelli successivi di questa catena: potremmo forse rendere i tumori squamosi meno aggressivi e più sensibili alle terapie esistenti?
Inoltre, la co-espressione di CD109 e IL-6Rα potrebbe diventare un utile strumento diagnostico o prognostico per identificare i pazienti a maggior rischio. Certo, la strada è ancora lunga e serviranno ulteriori studi, ma aver identificato questo “regista occulto” e i suoi complici ci dà una nuova chiave di lettura e nuove speranze per combattere questo tipo di cancro. Un piccolo passo nel laboratorio, ma potenzialmente un grande passo per i pazienti!
Fonte: Springer