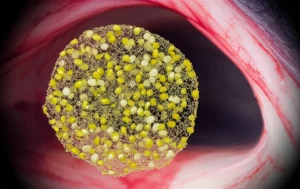
Cataratta Nucleare e Miopia Elevata: Svelato il Meccanismo d’Accelerazione
Ciao a tutti! Oggi voglio parlarvi di un argomento che mi affascina da tempo e che riguarda la vista di molte persone: il legame tra miopia elevata e l’insorgenza precoce di un tipo specifico di cataratta, quella nucleare. Se siete miopi elevati, forse sapete già che il rischio di sviluppare cataratta prima dei 50 anni è più alto rispetto a chi non ha questo difetto visivo. Ma perché proprio la cataratta *nucleare*, quella che colpisce il centro del cristallino, e perché così presto? È un mistero che abbiamo cercato di svelare.
Un Cristallino Diverso: Ordine e Compattazione nella Miopia Elevata
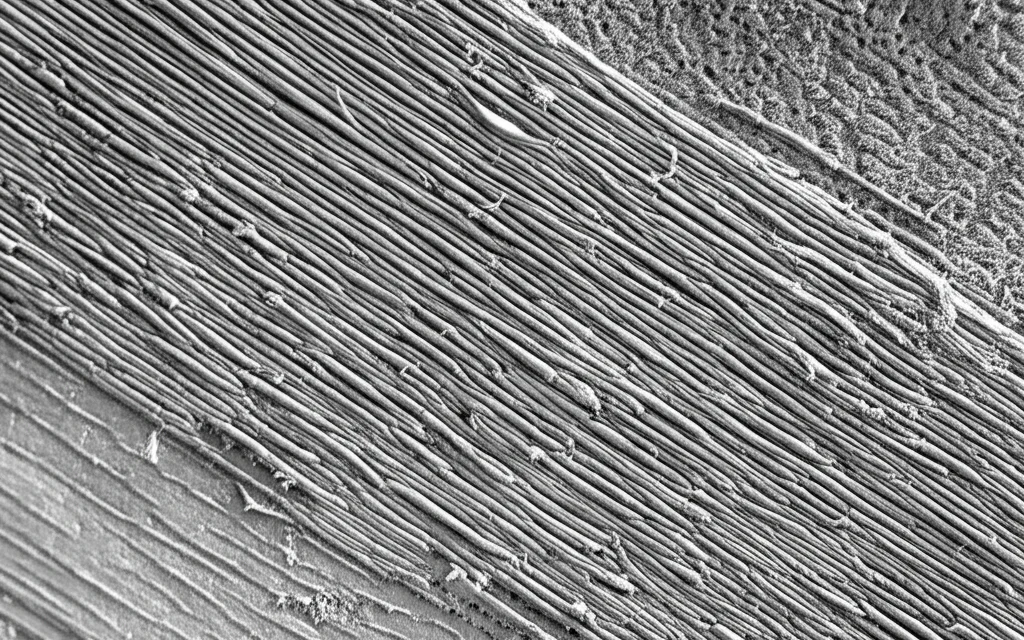
La prima cosa che ci ha colpito osservando i cristallini di pazienti con miopia elevata e cataratta (che chiameremo HMC, Highly Myopic Cataracts) è stata la loro struttura. A differenza della cataratta senile comune (ARC, Age-Related Cataracts), dove le fibre del cristallino nella parte esterna (corteccia) appaiono disordinate, nei pazienti HMC abbiamo notato un’organizzazione quasi maniacale: le fibre erano allineate in modo polarizzato e incredibilmente compatto, specialmente nel nucleo, un po’ come gli strati di una cipolla. Questa osservazione ci ha fatto pensare: deve esserci un meccanismo specifico all’opera nella miopia elevata che regola l’allineamento di queste fibre e che, in qualche modo, accelera l’indurimento (sclerosi) del nucleo. Anche le cellule epiteliali del cristallino (LECs) prelevate da questi pazienti mostravano un comportamento diverso in coltura: tendevano a migrare in modo orientato e ad allungarsi, segno di una spiccata polarità cellulare, cosa molto meno evidente nelle cellule da cataratta senile comune.
Il Ruolo del TGF-β1 e delle Modifiche m6A
Sapevamo già da studi precedenti che nei cristallini di persone con miopia elevata c’è un aumento di una molecola segnale chiamata TGF-β1 (Transforming Growth Factor-β1). Ci siamo chiesti se questo particolare “microambiente” potesse innescare dei cambiamenti a livello molecolare più profondo, magari modifiche epigenetiche che non alterano il DNA ma il modo in cui viene letto e utilizzato. Una di queste modifiche, molto studiata recentemente, è la N6-metiladenosina, o m6A. Immaginatela come una piccola etichetta chimica che viene apposta sull’RNA messaggero (mRNA), l’intermediario che porta le istruzioni dal DNA alle fabbriche di proteine della cellula. Queste etichette m6A possono influenzare la stabilità, la traduzione e il destino dell’mRNA. Ebbene, abbiamo scoperto che nei cristallini HMC c’era effettivamente un aumento significativo delle modifiche m6A sull’RNA totale, e questo aumento era collegato proprio ai livelli più alti di TGF-β1. Non solo: abbiamo visto che l’enzima “scrittore” responsabile dell’aggiunta di queste etichette, chiamato METTL3, era anch’esso più abbondante nelle cellule HMC, e il suo livello aumentava proprio in risposta al TGF-β1. Sembrava proprio che il TGF-β1 stesse “dicendo” alle cellule di mettere più etichette m6A!
La Via della Polarità Cellulare Planare (PCP) Sotto i Riflettori
Ma quali geni venivano “etichettati” con m6A e che effetto aveva tutto ciò? Analizzando l’intero panorama delle modifiche m6A (quello che chiamiamo mappa m6A trascrittomica), abbiamo notato che una delle vie di segnalazione cellulare più interessate era la via WNT/PCP (Planar Cell Polarity). Questa via è fondamentale durante lo sviluppo per organizzare le cellule in un tessuto, definire la loro polarità (cioè distinguere un “sopra” da un “sotto” o una “destra” da una “sinistra”) e coordinare i loro movimenti. È proprio la via PCP che orchestra la differenziazione e l’allineamento delle fibre del cristallino durante lo sviluppo embrionale. Ci siamo chiesti: possibile che questa via, normalmente attiva nello sviluppo, venga riattivata o potenziata in modo anomalo nella miopia elevata a causa delle modifiche m6A indotte dal TGF-β1? L’analisi ha rivelato che diversi geni chiave della via WNT/PCP erano più “etichettati” (ipermetilati) nelle cellule HMC. Tra questi, uno in particolare ha attirato la nostra attenzione: DVL2 (Dishevelled 2).
METTL3, IGF2BP3 e DVL2: Un Trio Inaspettato
Abbiamo scoperto che l’enzima METTL3 interagiva direttamente con l’mRNA di DVL2. Non solo, l’aumento di METTL3 portava a un aumento dei livelli di proteina DVL2 e all’attivazione di un suo effettore a valle, p-JNK, un classico marcatore dell’attivazione della via PCP non canonica. Ma come faceva l’etichetta m6A a potenziare DVL2? Qui entra in gioco un altro attore: la proteina “lettrice” di m6A, IGF2BP3. Abbiamo scoperto che anche IGF2BP3 era più abbondante nelle cellule HMC. Questa proteina è nota per legarsi agli mRNA etichettati con m6A e proteggerli dalla degradazione, rendendoli più stabili e longevi. Ed è esattamente quello che succedeva con DVL2: IGF2BP3 riconosceva l’etichetta m6A apposta da METTL3 sull’mRNA di DVL2 e lo stabilizzava. In pratica, il TGF-β1 induceva METTL3 a etichettare DVL2, e IGF2BP3 leggeva l’etichetta e impediva che l’mRNA venisse distrutto troppo in fretta. Il risultato? Più proteina DVL2 e una via PCP più attiva.
Le Conseguenze: Cellule Più Attive, Cristallino Più Compatto
Cosa comporta questa attivazione della via PCP mediata da m6A? Abbiamo visto che influenzava direttamente il comportamento delle cellule epiteliali del cristallino (LECs):
- Aumentava la loro proliferazione (si moltiplicavano di più).
- Aumentava la loro migrazione (si muovevano di più).
- Promuoveva la loro formazione di polarità (si orientavano meglio).
Questi comportamenti, potenziati dall’asse TGF-β1-METTL3-m6A-IGF2BP3-DVL2-PCP, potrebbero spiegare perché le fibre del cristallino nei pazienti HMC sono così ordinate e compatte. È come se il processo di differenziazione e aggiunta di nuove fibre, che continua per tutta la vita ma rallenta con l’età, venisse accelerato e reso iper-efficiente nella miopia elevata, portando a una compressione concentrica più rapida del nucleo e, quindi, all’insorgenza precoce della cataratta nucleare. Abbiamo anche confermato questi effetti in modelli animali: topi in cui abbiamo ridotto specificamente METTL3 nel cristallino mostravano un disordine nell’allineamento delle fibre e, cosa importante, erano meno suscettibili all’aumento della densità nucleare indotto artificialmente da TGF-β1.
Conclusioni e Prospettive Future
Quindi, tirando le somme, il nostro studio suggerisce un meccanismo affascinante: nella miopia elevata, l’aumento di TGF-β1 stimola l’enzima METTL3 a mettere più etichette m6A sull’mRNA di DVL2. Queste etichette vengono lette dalla proteina IGF2BP3, che stabilizza l’mRNA di DVL2. Più DVL2 significa una via PCP più attiva, che a sua volta altera il comportamento delle cellule epiteliali del cristallino, promuovendo la loro proliferazione, migrazione e polarità. Questo processo porta a un allineamento più organizzato ma anche a una compattazione accelerata delle fibre del cristallino, culminando nella cataratta nucleare precoce. Questa scoperta non solo getta nuova luce su perché i miopi elevati sviluppino questo tipo specifico di cataratta, ma apre anche nuove, eccitanti prospettive terapeutiche. Immaginate se potessimo modulare l’attività di METTL3 o i livelli di m6A nel cristallino: potremmo forse rallentare o prevenire la progressione della cataratta nucleare in questi pazienti. Ogni nodo di questa via di segnalazione (TGF-β1, METTL3, m6A, IGF2BP3, DVL2, PCP) rappresenta un potenziale bersaglio per future terapie non chirurgiche. La ricerca continua, ma abbiamo aggiunto un tassello importante per capire e, speriamo un giorno, contrastare questa comune complicanza della miopia elevata.
Fonte: Springer