Sotto la Lente: Il Misterioso Carcinoma Renale Oncocitico a Basso Grado FH-Deficiente
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo della patologia renale, alla scoperta di un’entità tumorale tanto rara quanto intrigante: il cosiddetto carcinoma renale oncocitico a basso grado con deficit di fumarato idratasi (FH). Sembra un nome complicato, vero? Ma fidatevi, la storia dietro è davvero interessante e ci aiuta a capire quanto ancora ci sia da scoprire, anche in campi apparentemente ben definiti come l’oncologia renale.
Recentemente, insieme ad altri colleghi, abbiamo avuto l’opportunità di studiare cinque casi di questo tumore particolare. Perché è così speciale? Beh, immaginate un tumore renale che, al microscopio, assomiglia molto a un altro tipo noto come carcinoma renale succinato deidrogenasi-deficiente (SDHdRCC), ma che in realtà nasconde una “firma” molecolare completamente diversa, legata al gene FH.
Cos’è esattamente questo Tumore?
Prima di tuffarci nei dettagli dei nostri casi, facciamo un passo indietro. Il gene FH codifica per l’enzima fumarato idratasi, cruciale nel ciclo di Krebs (ricordate le lezioni di biologia?). Mutazioni patogenetiche in questo gene possono causare una sindrome ereditaria chiamata Leiomiomatosi Ereditaria e Carcinoma Renale (HLRCC). Chi ne è affetto ha una predisposizione a sviluppare leiomiomi (tumori benigni del muscolo liscio) della pelle e dell’utero, e, appunto, una forma aggressiva di carcinoma renale, noto come FHdRCC.
Tradizionalmente, l’FHdRCC è considerato un tumore piuttosto “cattivo”, con un alto grado di malignità e una prognosi spesso infausta. La sua morfologia può essere molto varia (papillare, solida, tubulocistica…), rendendo a volte difficile la diagnosi. Un segno distintivo, anche se non esclusivo, sono i macronucleoli eosinofili prominenti con alone perinucleolare. La diagnosi certa si basa sull’assenza della proteina FH e/o sulla positività per un marcatore chiamato 2-succinocisteina (2SC) all’immunoistochimica, oppure sulla conferma di una mutazione patogenetica nel gene FH.
Tuttavia, da qualche tempo, è emersa questa variante “a basso grado oncocitica”. Come suggerisce il nome, le cellule tumorali hanno un aspetto meno aggressivo (basso grado) e sono “oncocitiche”, cioè ricche di un citoplasma eosinofilo (rosa intenso) e granulare, che le fa assomigliare, come dicevo, agli SDHdRCC. L’Organizzazione Mondiale della Sanità (OMS) l’ha persino menzionata come una variante istologica emergente nella sua ultima classificazione. Ma i dati su questa forma sono ancora scarsi, basati su meno di 20 casi descritti in letteratura prima del nostro studio. Ecco perché abbiamo voluto approfondire!
Uno Sguardo al Microscopio: Cosa Abbiamo Visto
Nei nostri cinque casi (3 uomini e 2 donne, età tra 21 e 68 anni), i tumori erano relativamente piccoli (diametro medio 2.86 cm) e spesso scoperti casualmente durante controlli di routine. La maggior parte era asintomatica.
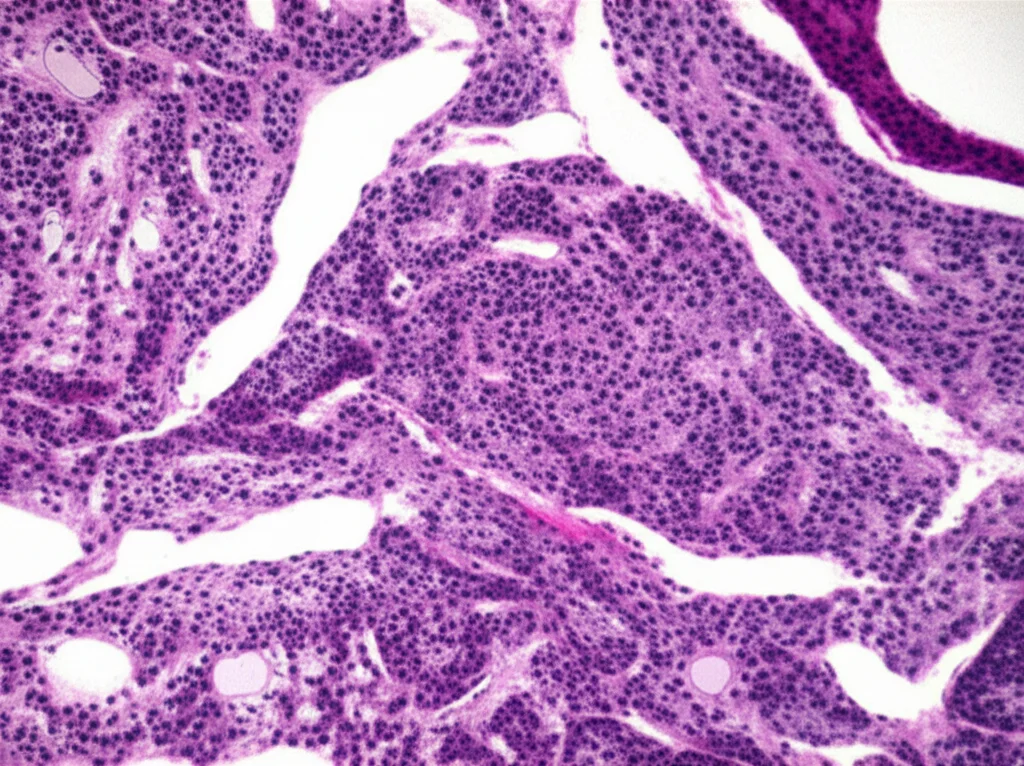
Al microscopio, questi tumori avevano delle caratteristiche ricorrenti:
- Una capsula fibromuscolare, spesso spessa, che li circondava. Interessante notare che frequentemente trovavamo cellule tumorali che invadevano questa capsula.
- Una struttura prevalentemente a nidi compatti e/o tubuli, immersi in una rete di vasi sanguigni sottili. Niente strutture papillari.
- Le cellule tumorali erano il pezzo forte: grandi, con abbondante citoplasma eosinofilo denso, che in molti casi dava un aspetto quasi “a vetro smerigliato” (ground glass-like). Questa è una caratteristica che non era stata enfatizzata prima, ma che secondo me è abbastanza distintiva.
- Presenza variabile di vacuoli intracitoplasmatici (piccole bolle nel citoplasma).
- In alcune aree, cellule più pallide con citoplasma “flocculare”, ma senza le tipiche inclusioni chiare degli SDHdRCC.
- Nonostante il basso grado predominante, in due casi abbiamo notato focale pleomorfismo nucleare (nuclei di forme e dimensioni diverse) e cellule multinucleate. Questo ci ricorda che “basso grado” non significa sempre “uniformità assoluta”.
- In un caso, c’erano anche aree con alone chiaro attorno al nucleo (perinucleare), che potevano far pensare ad altre entità come il carcinoma cromofobo eosinofilo o il tumore oncocitico a basso grado (LOT).
- Altre scoperte occasionali includevano infiltrati infiammatori, aree edematose o ialine, e persino ossificazione (formazione di osso) in due casi.
Importante: nessuno dei tumori mostrava necrosi (morte cellulare massiva) o trasformazione sarcomatoide/rabdoide, segni tipici di aggressività.
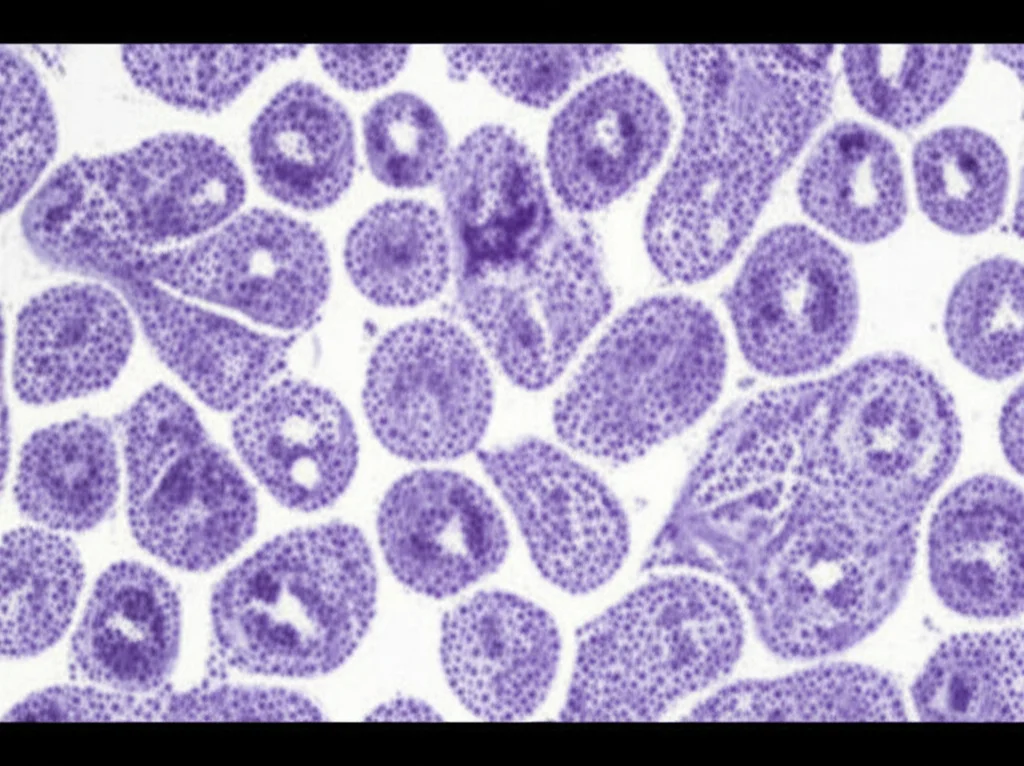
Indizi Molecolari e Immunoistochimici: Il Puzzle Diagnostico
L’immunoistochimica (IHC) è fondamentale qui. Usiamo anticorpi per “colorare” specifiche proteine nelle cellule tumorali. Ci aspettavamo il classico profilo FH-negativo / 2SC-positivo, tipico della deficienza di FH. E infatti, due dei nostri cinque casi lo mostravano chiaramente.
Ma ecco la sorpresa: gli altri tre casi erano FH-positivi ma comunque 2SC-positivi! Questo pattern è meno comune ma noto, spesso associato a mutazioni “missenso” nel gene FH che producono una proteina presente ma non funzionante. Questo ci insegna che non dobbiamo escludere un FHdRCC solo perché l’FH risulta positivo all’IHC, specialmente se il 2SC è positivo e il quadro clinico-patologico è suggestivo.
Un’altra osservazione interessante riguarda la localizzazione del 2SC: nei nostri casi era prevalentemente citoplasmatica, mentre alcuni studi precedenti enfatizzavano l’importanza di una positività sia nucleare che citoplasmatica. Le ragioni di questa discrepanza non sono chiare, forse legate ai diversi anticorpi usati.
Per quanto riguarda gli altri marcatori IHC:
- Tutti i casi erano positivi per PAX8, Vimentina, P504s e SDHB (quest’ultimo importante per escludere SDHdRCC, che invece lo perde).
- Negativi per CD117 (utile per distinguerli dall’oncocitoma renale), CA9, ALK, Catepsina-K, CK20.
- La CK7 era eterogenea e presente solo in due casi, aiutando a distinguerli da altri tumori oncocitici come il LOT che spesso la esprime diffusamente.
- Curiosamente, 4 su 5 casi erano positivi per TFE3. Questo marcatore è tipicamente associato a un altro tipo di carcinoma renale (quello con traslocazioni di TFE3), ma nei nostri casi testati con FISH, non c’erano traslocazioni. Probabilmente si tratta di un’espressione “costitutiva”, non legata a riarrangiamenti genetici specifici.
Scavando nel DNA: Le Mutazioni Confermano
Per avere la prova definitiva, siamo andati a cercare le mutazioni direttamente nel gene FH usando tecniche di sequenziamento di nuova generazione (NGS), come il Whole Exome Sequencing (WES) o PCR multiplex.
I risultati hanno confermato la diagnosi:
- Un caso con fenotipo IHC FH-/2SC+ aveva una mutazione FH patogenetica (stop codon prematuro).
- Due casi con fenotipo IHC FH+/2SC+ avevano mutazioni FH missenso patogenetiche o probabilmente patogenetiche. Una di queste era già nota in letteratura e associata proprio a questo fenotipo IHC. L’altra, sebbene non ancora classificata come patogenetica in database come ClinVar, era predetta come dannosa da strumenti bioinformatici (SIFT, PolyPhen).
- Un caso FH+/2SC+ aveva una mutazione FH germinale (presente in tutte le cellule dell’organismo) di significato incerto, ma associata alla perdita di una copia del cromosoma 1 (dove risiede il gene FH) e di altri cromosomi (8 e 14). Riteniamo che questa combinazione (mutazione germinale “debole” + perdita dell’altra copia normale del gene) possa essere la causa del tumore in questo paziente giovane con noduli multipli bilaterali, suggerendo una possibile sindrome HLRCC sottostante.
- In un solo caso FH-/2SC+, non siamo riusciti a trovare mutazioni, probabilmente a causa della scarsa qualità del DNA estratto dal tessuto fissato in formalina e incluso in paraffina (FFPE), che non ha permesso un’analisi completa del gene.
Questi dati molecolari sono cruciali perché confermano che, nonostante l’aspetto a basso grado e talvolta l’espressione conservata di FH, questi tumori appartengono effettivamente allo spettro degli FHdRCC.
Prognosi e Sfide Future: Cosa Ci Dice Tutto Questo?
E la prognosi? Sembra essere la buona notizia. Nonostante l’FHdRCC classico sia aggressivo, questa variante oncocitica a basso grado sembra comportarsi meglio. Tutti i nostri pazienti erano vivi al follow-up (durata mediana 46 mesi), e solo uno aveva una massa stabile nel rene controlaterale non operata. Questo è in linea con la maggior parte dei pochi casi descritti in letteratura con follow-up adeguato. Su circa 15 casi noti (inclusi i nostri) seguiti per più di 6 mesi, la stragrande maggioranza (circa 87%) non ha mostrato progressione di malattia.
Certo, dobbiamo essere cauti. Il numero di casi è ancora piccolo, il follow-up non è lunghissimo per tutti, e abbiamo visto che possono esserci atipie focali. Inoltre, un caso in letteratura è deceduto per metastasi, e un altro ha sviluppato un FHdRCC di alto grado successivamente. Quindi, un follow-up a lungo termine rimane essenziale. Il basso grado istologico potrebbe non riflettere completamente il potenziale biologico, e fattori come la dimensione del tumore e l’invasione capsulare vanno considerati.
La sfida principale rimane la diagnosi differenziale. Questi tumori possono mimare l’SDHdRCC, l’oncocitoma renale (RO), il LOT, e persino varianti di carcinoma cromofobo o papillare. Ecco perché un pannello IHC mirato (FH, 2SC, SDHB, Vimentina, CK7, CD117) è fondamentale quando ci si trova di fronte a un tumore renale oncocitico a basso grado.
In conclusione, il carcinoma renale oncocitico a basso grado FH-deficiente è un’entità rara ma reale, con caratteristiche clinicopatologiche e molecolari distinte. Sembra avere una prognosi relativamente favorevole rispetto alla forma convenzionale, ma richiede un’attenta diagnosi differenziale e un follow-up prolungato. Il nostro studio aggiunge cinque tasselli a questo puzzle, ampliando lo spettro morfologico e confermando l’importanza dell’analisi molecolare e di un corretto pannello immunoistochimico. C’è ancora molto da imparare, e ogni nuovo caso ci aiuta a definire meglio questa affascinante variante tumorale!
Fonte: Springer