Cancro al Polmone: Come le Cellule Ribelli Ingannano la Morte da Rame Grazie ai Super-Enhancer
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle cellule tumorali, in particolare quelle dell’adenocarcinoma polmonare (LUAD), una delle forme più comuni e letali di cancro al polmone. Ci addentreremo in un meccanismo di sopravvivenza cellulare davvero sorprendente che ho avuto modo di studiare e che lega insieme stress cellulare, regioni potentissime del nostro DNA chiamate super-enhancer e un tipo di morte cellulare programmata molto particolare, indotta dal rame: la cuproptosi.
Il Rame: Amico o Nemico delle Cellule Tumorali?
Il rame è un elemento essenziale per la vita, ma nel contesto del cancro, la sua storia si complica. Sembra essere un’arma a doppio taglio: livelli moderati di rame possono favorire la crescita del tumore, mentre un eccesso può scatenare la cuproptosi, una forma di morte cellulare scoperta relativamente di recente (nel 2022!) che dipende proprio da un sovraccarico di questo metallo. Immaginate il rame che si lega direttamente a componenti chiave del metabolismo cellulare (proteine lipoilate nel ciclo dell’acido tricarbossilico), causandone l’aggregazione e mandando la cellula in tilt fino alla morte.
La domanda che mi sono posto è stata: cosa succede nell’adenocarcinoma polmonare (LUAD)? Questi tumori come si relazionano con la cuproptosi? Analizzando campioni di tessuto tumorale LUAD, abbiamo fatto una scoperta interessante: questi tumori tendono ad accumulare più rame rispetto ai tessuti sani circostanti. E non solo: i tumori più aggressivi (di alto grado) ne accumulavano ancora di più! Questo suggerirebbe che dovrebbero essere più suscettibili alla cuproptosi, giusto? Eppure, non sembrava così. Anzi, i livelli di FDX1, una proteina chiave per *innescare* la cuproptosi, erano *ridotti* nei tumori di alto grado. Un vero paradosso! Come facevano queste cellule a sopravvivere, anzi, a prosperare in un ambiente così ricco di rame?
La Risposta Nascosta nello Stress Cellulare: Entra in Scena XBP1s
Per capirci qualcosa di più, ci siamo tuffati nell’analisi a singola cellula (single-cell RNA sequencing) di campioni tumorali LUAD di basso e alto grado. Questa tecnica potentissima ci permette di “ascoltare” cosa succede in ogni singola cellula. E cosa abbiamo sentito? Nelle cellule dei tumori di alto grado, c’era un gran fermento legato alla risposta allo stress del reticolo endoplasmatico (ER stress), noto anche come Unfolded Protein Response (UPR). L’UPR è un sistema di allarme e di difesa che le cellule attivano quando le proteine si accumulano in modo errato nel reticolo endoplasmatico.
Un attore chiave dell’UPR è una proteina chiamata XBP1. In condizioni di stress, l’RNA di XBP1 subisce uno “splicing” (un taglio e ricucitura) particolare che genera una forma attiva, chiamata XBP1s. Questa forma attiva è un fattore di trascrizione, cioè va nel nucleo e accende o spegne specifici geni per aiutare la cellula a fronteggiare lo stress. Ebbene, abbiamo scoperto che proprio XBP1s era particolarmente attivo nelle cellule LUAD di alto grado, quelle più resistenti alla cuproptosi e con più rame. Non solo, analisi su campioni più ampi hanno confermato che alti livelli di XBP1s sono associati a forme più aggressive di LUAD e a una prognosi peggiore. Poteva essere XBP1s la chiave per capire la resistenza alla cuproptosi?

XBP1s: Un Architetto Molecolare che Costruisce “Condensati”
Approfondendo le caratteristiche di XBP1s, abbiamo notato che possiede regioni intrinsecamente disordinate (IDR), tratti di proteina flessibili che spesso sono coinvolti in un fenomeno affascinante chiamato separazione di fase liquido-liquido (LLPS). Immaginate delle goccioline d’olio che si formano nell’acqua: l’LLPS permette alle proteine e ad altre molecole di concentrarsi in “condensati” simili a gocce, senza bisogno di membrane, creando compartimenti funzionali all’interno della cellula.
Esperimenti *in vitro* hanno mostrato che XBP1s purificato è in grado di formare spontaneamente queste goccioline. E cosa ancora più interessante, osservando cellule LUAD vive al microscopio, abbiamo visto che XBP1s formava proprio questi condensati (o “puncta”) nel nucleo. Ma la vera sorpresa è stata vedere che trattando le cellule con elesclomol (ES), un farmaco che trasporta rame all’interno delle cellule inducendo la cuproptosi, il numero e le dimensioni di questi condensati di XBP1s aumentavano significativamente! Era come se lo stress da rame spingesse XBP1s a organizzarsi in queste strutture. La regione IDR di XBP1s si è rivelata cruciale per questo fenomeno.
Super-Enhancer al Lavoro: XBP1s Potenzia un Gene Chiave
Ma a cosa servono questi condensati di XBP1s nel nucleo? Ricerche precedenti avevano suggerito che l’LLPS è alla base della formazione dei cosiddetti Super-Enhancer (SEs). Gli SEs non sono geni, ma lunghe regioni del DNA piene zeppe di elementi regolatori che agiscono come potentissimi interruttori per accendere specifici geni, spesso quelli che definiscono l’identità e il destino di una cellula, o che sono cruciali per la sua sopravvivenza in condizioni difficili, come nel cancro.
La nostra ipotesi era che i condensati di XBP1s fossero proprio dei SEs. E le prove hanno iniziato ad accumularsi! Abbiamo visto che nei condensati di XBP1s si concentravano anche altre proteine note per essere componenti chiave degli SEs, come P300, MED1 e BRD4. Inoltre, questi condensati si trovavano in zone del nucleo ricche di marcatori di attivazione genica (come H3K27ac) e di RNA polimerasi II attiva, la macchina che trascrive i geni in RNA.
Ma quale gene veniva potenziato da questi SEs guidati da XBP1s? Utilizzando tecniche avanzate come CUTeTag-seq (che mappa dove le proteine si legano al DNA) in cellule trattate con diverse concentrazioni di rame (indotte da ES), abbiamo scoperto che XBP1s e i suoi compagni si accumulavano in modo massiccio vicino a un gene chiamato MGRN1. MGRN1 codifica per una E3 ubiquitina ligasi, un tipo di enzima che “etichetta” altre proteine per la degradazione. Esperimenti di cattura della conformazione cromosomica (3C) hanno confermato che, sotto stress da rame, le regioni SEs lontane si avvicinavano fisicamente al promotore di MGRN1, grazie proprio alla presenza di XBP1s, potenziandone la trascrizione. In pratica, XBP1s, formando SEs tramite LLPS, accendeva a tutto volume il gene MGRN1 in risposta all’accumulo di rame.

La Cascata di Eventi: MGRN1 Distrugge LIPT1 e Blocca la Cuproptosi
Ora avevamo la sequenza: Rame -> Stress ER -> XBP1s -> Formazione di SEs -> Attivazione di MGRN1. Ma come faceva questo a bloccare la cuproptosi? La risposta doveva trovarsi nel bersaglio di MGRN1. Ricordate le proteine chiave della cuproptosi? Una di queste è LIPT1. Analisi proteomiche (che studiano l’insieme delle proteine in una cellula) hanno rivelato che quando XBP1s era sovraespresso, i livelli della proteina LIPT1 diminuivano drasticamente, anche se il suo RNA rimaneva invariato. Questo suggeriva una degradazione post-traduzionale.
Esperimenti successivi hanno confermato il sospetto: MGRN1 interagisce direttamente con LIPT1 e la marca con catene di ubiquitina di tipo K48, il segnale classico per la distruzione da parte del proteasoma. Quindi, la catena completa era: XBP1s attiva MGRN1, che a sua volta distrugge LIPT1. Poiché LIPT1 è essenziale per la cuproptosi, la sua eliminazione rende le cellule resistenti alla morte indotta dal rame! Abbiamo confermato questo meccanismo: sovraesprimere XBP1s proteggeva le cellule LUAD dalla morte indotta da ES, ma se contemporaneamente si ripristinavano i livelli di LIPT1, questa protezione svaniva.
Non Solo Resistenza: La Riprogrammazione Metabolica
Ma non è finita qui. La perdita di LIPT1 ha un’altra conseguenza importante. LIPT1 è coinvolta nel ciclo dell’acido tricarbossilico (TCA), il cuore della respirazione mitocondriale. Bloccando questo ciclo a causa della mancanza di LIPT1, le cellule tumorali sono costrette a trovare un’altra via per produrre energia: la glicolisi, un processo meno efficiente ma più rapido che avviene nel citoplasma. Ed ecco un altro colpo di scena: le cellule che dipendono dalla glicolisi sono intrinsecamente molto meno sensibili alla cuproptosi rispetto a quelle che si affidano alla respirazione mitocondriale!
I nostri esperimenti lo hanno confermato: le cellule con alti livelli di XBP1s (e quindi bassi di LIPT1) mostravano un aumento della glicolisi (più produzione di lattato e acidificazione extracellulare) e una riduzione del consumo di ossigeno (indice di respirazione mitocondriale). Incredibilmente, abbiamo anche notato che XBP1s aumentava i livelli di un’altra proteina, DLAT, anch’essa legata sia alla cuproptosi che alla promozione della glicolisi. Quindi, XBP1s non solo blocca direttamente la cuproptosi degradando LIPT1, ma riprogramma anche il metabolismo cellulare verso la glicolisi, rendendo le cellule doppiamente resistenti al rame.

Dalle Cellule ai Topi: La Prova del Nove
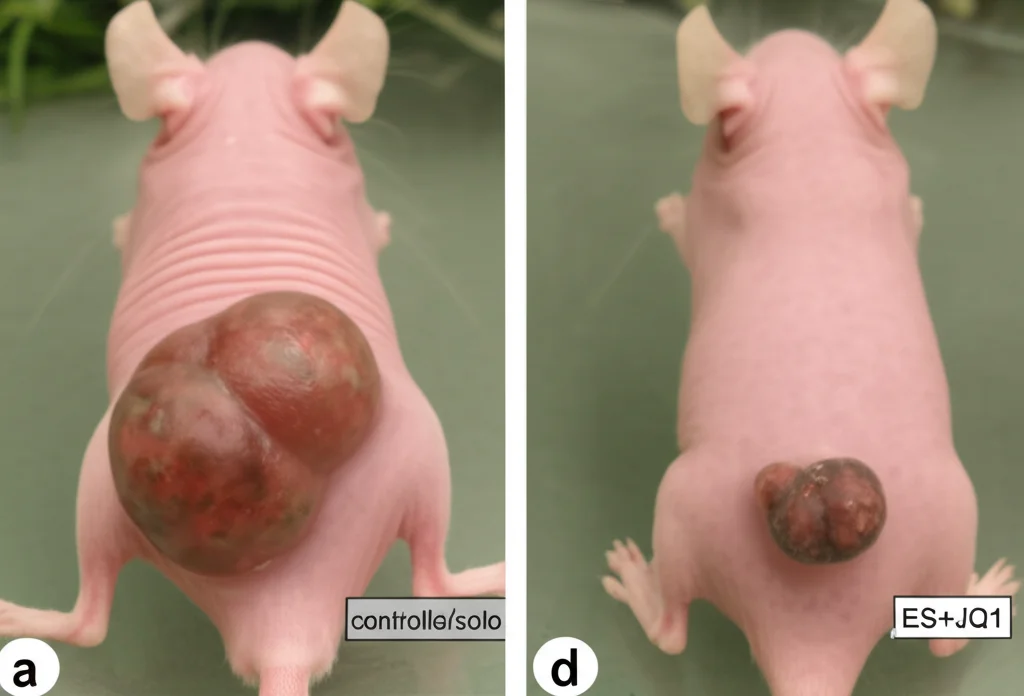
Per essere sicuri che questo meccanismo complesso funzionasse anche in un organismo vivente, siamo passati ai modelli animali (*in vivo*). Abbiamo impiantato cellule di LUAD umane in topi immunodeficienti. I risultati sono stati chiari:
- I tumori formati da cellule che sovraesprimevano XBP1s crescevano di più e resistevano meglio al trattamento con l’induttore di cuproptosi ES.
- Se in queste cellule resistenti si bloccava MGRN1, la resistenza a ES veniva persa.
- Infine, la prova regina: combinare ES con JQ1, un farmaco che inibisce i SEs (bloccando l’azione di BRD4, uno dei compagni di XBP1s), riduceva drasticamente la crescita tumorale, molto più dei singoli trattamenti.
Questi esperimenti hanno confermato l’asse XBP1s-MGRN1-LIPT1 come un meccanismo cruciale di resistenza alla cuproptosi nel LUAD e hanno aperto la strada a nuove strategie terapeutiche.
Implicazioni e Sguardo al Futuro
Questa ricerca svela un meccanismo molecolare affascinante con cui le cellule di adenocarcinoma polmonare si difendono dalla morte indotta da un eccesso di rame. Lo stress del reticolo endoplasmatico attiva XBP1s, che attraverso la formazione di super-enhancer mediata da LLPS, potenzia il gene MGRN1. Questo porta alla degradazione di LIPT1, bloccando la cuproptosi e spingendo la cellula verso la glicolisi, conferendo ulteriore resistenza.
Dal punto di vista terapeutico, questi risultati sono promettenti. Suggeriscono che combinare farmaci che inducono la cuproptosi (come gli ionofori del rame, tipo ES) con inibitori dei super-enhancer (come JQ1) potrebbe essere una strategia efficace per colpire le vulnerabilità metaboliche e trascrizionali del LUAD, specialmente nei tumori con alti livelli di XBP1s. Proprio XBP1s potrebbe diventare un utile biomarcatore per selezionare i pazienti che potrebbero beneficiare maggiormente di questo approccio combinato.
Certo, la strada è ancora lunga. Bisognerà testare altri induttori di cuproptosi, utilizzare modelli preclinici più complessi (come organoidi o tumori derivati da pazienti) e capire meglio le soglie terapeutiche ottimali, considerando la natura duale sia del rame che dell’UPR (un eccesso di entrambi può essere letale).
Tuttavia, aver svelato questo intricato dialogo tra stress cellulare, epigenetica (SEs), metabolismo e morte cellulare ci offre una nuova prospettiva sulla biologia del cancro al polmone e apre nuove, entusiasmanti possibilità per combatterlo. Spero che questo viaggio nel microscopico vi abbia affascinato quanto ha affascinato me scoprirlo!
Fonte: Springer