Camelot: Svelare i Segreti Meccanici delle Piante Non È Mai Stato Così Accessibile (ed Economico!)
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona tantissimo: come fanno le piante a crescere e a prendere forme così diverse e meravigliose? Sembra semplice, ma dietro c’è un mondo complesso fatto di geni, segnali chimici e, udite udite, forze meccaniche! Sì, avete capito bene, anche le piante “sentono” e rispondono alle forze, un po’ come i nostri muscoli.
La Danza tra Pressione e Parete Cellulare
Immaginate ogni cellula vegetale come un piccolo palloncino pieno d’acqua (è la pressione di turgore) racchiuso in una scatola robusta ma flessibile (la parete cellulare). Questa pressione spinge dall’interno, tendendo la parete. Ma per crescere, la parete deve potersi “allungare” in modo permanente, un processo chiamato creep. Qui entrano in gioco delle speciali proteine, come le espansine, che agiscono un po’ come delle “chiavi molecolari” che allentano la parete permettendole di espandersi sotto la spinta del turgore, ma solo se la tensione supera una certa soglia. È un equilibrio delicato: troppa rigidità e la crescita si ferma, troppa poca e la pianta non avrebbe struttura. Capire come funzionano queste forze a livello microscopico è fondamentale, ma misurarle… beh, non è proprio una passeggiata.
Il Problema: Misurare Forze Minuscole Senza Sfondare il Budget
Per studiare le proprietà meccaniche dei tessuti vegetali, come la loro rigidità (il famoso modulo di Young), la loro capacità di deformarsi plasticamente (il creep) o la forza necessaria a romperli (lo stress di rottura), gli scienziati usano strumenti chiamati estensometri. In pratica, si prende un pezzettino di tessuto (ad esempio, un piccolo fusto o una strisciolina di foglia) e lo si tira delicatamente, misurando quanta forza serve per allungarlo di una certa quantità.
I moderni micro-estensometri, adatti a campioni piccolissimi come l’ipocotile (il “fusticino” iniziale) di una piantina di Arabidopsis (la nostra “cavia” vegetale preferita), sono strumenti sofisticati. Usano attuatori computerizzati per controllare il movimento e sensori precisissimi per misurare la forza. Il problema? Spesso questi gioiellini tecnologici costano un occhio della testa! Parliamo di migliaia, se non decine di migliaia di euro, cifre proibitive per molti laboratori, specialmente quelli con budget limitati o per chi è alle prime armi con la biomeccanica.
Inoltre, c’è un’altra bella gatta da pelare: anche con strumenti super precisi, misurare l’allungamento *reale* del campione è difficile. Perché? Perché il campione può scivolare dai morsetti che lo tengono, o i punti di attacco stessi possono flettersi. Se ci si basa solo sullo spostamento dell’attuatore, si rischia di sovrastimare l’allungamento del tessuto, ottenendo misure di rigidità sballate. La soluzione? Guardare direttamente il campione mentre si deforma!

Ecco Camelot: Il Cavaliere a Basso Costo della Biomeccanica
Ed è qui che entra in scena il protagonista della nostra storia: Camelot! No, non stiamo parlando del castello di Re Artù, ma di un sistema di micro-estensometro geniale, sviluppato proprio per superare questi ostacoli. L’idea di base è semplice ma potente: costruire un estensometro preciso e affidabile utilizzando componenti elettronici e meccanici facilmente reperibili e a basso costo, il tutto controllato da un software open-source.
Pensate un po’: invece di costosissimi attuatori piezoelettrici, Camelot usa un attuatore a vite mosso da un motorino passo-passo (simili a quelli usati nelle stampanti 3D o piccole macchine CNC), che costa poche decine di euro e offre comunque una risoluzione di movimento di circa 5 micrometri (millesimi di millimetro!). Per misurare la forza, usa una piccola cella di carico, simile a quelle che si trovano nelle bilance digitali di precisione, anch’essa molto economica (parliamo di una decina di euro!).
La vera magia, però, sta nell’integrazione con il tracciamento ottico e nel software. Camelot è pensato per lavorare insieme a una telecamera (anche una semplice webcam USB o un microscopio digitale da poche decine di euro) che riprende il campione durante l’esperimento. Il software che gestisce tutto, chiamato MorphoRobotX (anch’esso gratuito e open-source!), non solo controlla l’attuatore e registra la forza, ma acquisisce anche le immagini dalla telecamera in modo sincronizzato.
Guardare per Credere: L’Importanza del Tracciamento Ottico
Perché è così importante la telecamera? Perché ci permette di misurare l’allungamento *reale* del campione, fregandocene di eventuali scivolamenti o flessioni dei supporti! Come? Possiamo mettere dei piccoli segni di riferimento direttamente sul campione (basta un pennarello indelebile a punta fine) e poi, analizzando le immagini scattate durante l’esperimento, misurare quanto si sono allontanati questi segni. In alternativa, se usiamo Camelot sotto un microscopio, possiamo usare le giunzioni tra le cellule stesse come punti di riferimento!
Questo approccio, chiamato tracciamento ottico, fa tutta la differenza. Negli esperimenti che abbiamo condotto, abbiamo visto che basarsi solo sul movimento dell’attuatore può portare a sovrastimare l’allungamento (la strain) anche di 10 volte rispetto a quello misurato otticamente! Questo errore si ripercuoterebbe direttamente sul calcolo della rigidità (Modulo di Young), sottostimandola enormemente. Con Camelot e il tracciamento ottico, invece, otteniamo misure molto più accurate e affidabili.
Camelot alla Prova dei Fatti: Esperimenti Concreti
Ma funziona davvero? Assolutamente sì! Abbiamo messo alla prova Camelot in diverse configurazioni.
- Configurazione Base: Usando la versione più semplice, con un microscopio digitale USB, abbiamo misurato le proprietà meccaniche degli ipocotili di Arabidopsis. Abbiamo confrontato piantine normali (wild-type) con mutanti chiamati xxt1 xxt2, che hanno una parete cellulare diversa perché manca una componente chiamata xiloglucano. I risultati? Camelot è stato perfettamente in grado di rilevare le differenze: le piantine normali sono risultate circa 5 volte più rigide e resistevano a più del doppio della forza prima di rompersi rispetto ai mutanti. Questi dati sono in linea con studi precedenti fatti con strumenti ben più costosi! Abbiamo anche fatto esperimenti di creep, vedendo come il tessuto si deforma lentamente nel tempo sotto una forza costante.
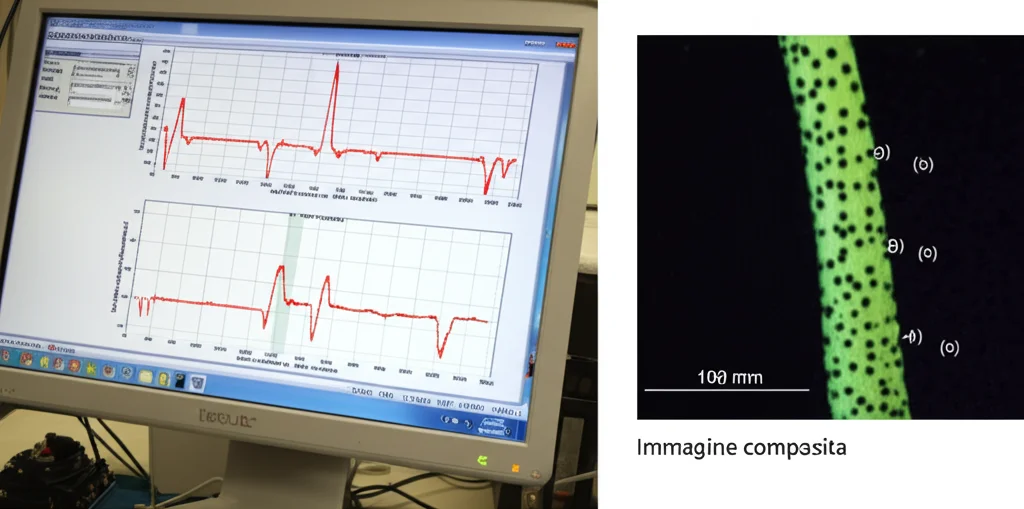
- Sotto il Microscopio Ottico: Abbiamo poi montato Camelot sulla platina di un microscopio invertito, usando una telecamera scientifica (tipo C-mount) per osservare le cellule. Abbiamo stirato delle sottili pellicine di cipolla (epidermide) sia in senso longitudinale che trasversale. Anche qui, i risultati sono stati chiarissimi e coerenti con la letteratura: l’epidermide di cipolla è quasi due volte più rigida se tirata lungo l’asse principale delle cellule rispetto a quando viene tirata trasversalmente. E grazie alla telecamera, abbiamo potuto misurare l’allungamento guardando direttamente le giunzioni tra le cellule, ottenendo misure di strain precisissime.
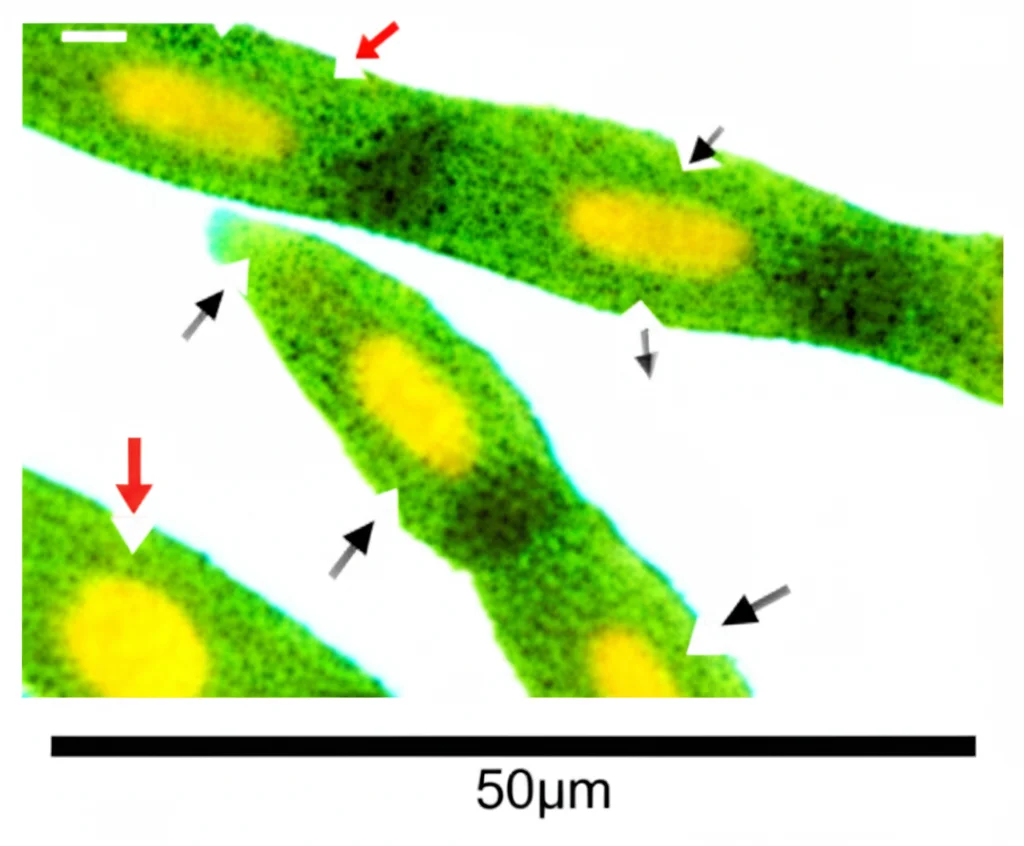
- Integrazione con il Confocale: Per il massimo dettaglio, abbiamo persino accoppiato Camelot a un microscopio confocale! Questo ci ha permesso di ottenere immagini 3D ad altissima risoluzione delle cellule di una foglia di Arabidopsis (usando piante geneticamente modificate per rendere fluorescenti le membrane cellulari) mentre venivano stirate. Analizzando queste immagini con un altro software open-source (MorphoGraphX), abbiamo potuto visualizzare come ogni singola cellula si deforma: si allunga nella direzione della forza applicata e si contrae perpendicolarmente (il cosiddetto effetto Poisson).
Perché Camelot è Rivoluzionario?
Il bello di Camelot sta nella sua accessibilità e versatilità.
- Costo Ridotto: Un sistema Camelot completo, pronto all’uso, può essere assemblato con meno di 500 euro. Un’inezia rispetto ai sistemi commerciali!
- Componenti Comuni: Utilizza parti elettroniche e meccaniche standard, facili da trovare e sostituire.
- Software Open-Source: MorphoRobotX è gratuito, gira su Linux (anche su Windows tramite WSL), è flessibile e supporta già diversi tipi di attuatori, sensori e telecamere. Essendo open-source, può essere modificato e adattato a esigenze specifiche.
- Facilità d’Uso e Assemblaggio: Il sistema è modulare, con parti principali stampabili in 3D (i file .stl sono disponibili!). L’assemblaggio e la calibrazione sono relativamente semplici seguendo le istruzioni.
- Precisione Grazie all’Ottica: L’integrazione nativa con il tracciamento ottico permette di superare i limiti legati allo scivolamento del campione, garantendo misure accurate della deformazione tissutale o cellulare.
- Adattabilità: Può essere usato da solo, con un semplice microscopio USB, o integrato con microscopi ottici o confocali più avanzati.
Certo, non avrà la risoluzione nanometrica di alcuni sistemi da decine di migliaia di euro, ma per la stragrande maggioranza degli esperimenti di biomeccanica su campioni biologici, la sua precisione (attorno ai 5 µm per l’attuatore, ma limitata di fatto dalla precisione della misura ottica) è più che sufficiente.
Il Futuro è Open e Accessibile
Camelot dimostra come, combinando in modo intelligente hardware a basso costo e software open-source, sia possibile creare strumenti scientifici potenti e accessibili. Abbassa le barriere economiche e tecniche, permettendo a più ricercatori, studenti e laboratori in tutto il mondo (anche quelli con risorse limitate) di esplorare l’affascinante mondo della biomeccanica vegetale.
Potenziali miglioramenti futuri potrebbero includere il riconoscimento automatico dei landmark tramite intelligenza artificiale o l’uso di attuatori ancora più performanti (già supportati dal software, per chi ne avesse bisogno e budget), ma già così com’è, Camelot rappresenta un passo avanti significativo per rendere la scienza più aperta e democratica.
Quindi, la prossima volta che ammirate una pianta, pensate alle incredibili forze meccaniche che ne modellano la crescita. E sappiate che oggi, grazie a strumenti come Camelot, svelare i loro segreti è diventato molto, molto più facile!
Fonte: Springer







