Poliammine e Canali TRPV3: Un Inaspettato Meccanismo di Blocco Svelato!
Ciao a tutti, appassionati di scienza e curiosi del corpo umano! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico delle nostre cellule, per scoprire come delle piccole molecole, le poliammine, riescano a “mettere un freno” a dei canali importantissimi per le nostre sensazioni: i canali TRPV3. Preparatevi, perché la storia ha dei risvolti davvero sorprendenti!
I Protagonisti della Nostra Storia: Canali TRPV e Poliammine
Prima di addentrarci nel vivo della scoperta, facciamo conoscenza con i nostri protagonisti. I canali TRPV (pronunciateli “trip-vi”) sono una famiglia di proteine che si trovano sulla membrana delle nostre cellule e agiscono come dei veri e propri guardiani molecolari. In particolare, i canali TRPV1-4 sono coinvolti in una miriade di processi fisiologici: dalla percezione del calore e del dolore, alla termoregolazione, fino alla sensazione di prurito. Immaginateveli come delle porte che si aprono e si chiudono per far passare ioni (particelle cariche) attraverso la membrana cellulare, scatenando così una risposta nel nostro corpo. È fondamentale che la loro attività sia finemente controllata: un’eccessiva apertura può portare a problemi come dolore cronico o infiammazione.
E poi ci sono loro, le poliammine: putrescina, spermidina e, soprattutto, la spermina. Non fatevi ingannare dai nomi un po’ bizzarri! Queste molecole organiche cariche positivamente sono presenti in tutte le nostre cellule e svolgono ruoli cruciali: regolano l’espressione dei geni, sono coinvolte nella crescita e proliferazione cellulare, nell’infiammazione e persino nelle risposte immunitarie. Pensate che i loro livelli cambiano con l’età e sono spesso alterati in malattie neurodegenerative o in vari tipi di cancro. Insomma, sono piccole ma potentissime!
Già in passato, noi ricercatori avevamo notato che le poliammine intracellulari possono inibire i canali TRPV1-4 in un modo che dipende dal voltaggio elettrico della membrana cellulare. L’ipotesi era che la spermina, essendo carica positivamente, potesse legarsi all’interno del poro del canale (il tunnel attraverso cui passano gli ioni) e addirittura attraversarlo. Ma i dettagli molecolari di questo blocco, soprattutto per il canale TRPV3 (dove l’effetto è più forte), erano ancora avvolti nel mistero.
A Caccia del Sito di Interazione: Un’Indagine tra Elettrofisiologia e Mutazioni
Per svelare questo mistero, abbiamo unito due tecniche potentissime: l’elettrofisiologia (che ci permette di “ascoltare” le correnti elettriche che passano attraverso i canali) e la crio-microscopia elettronica (cryo-EM) (che ci dà immagini tridimensionali delle proteine a risoluzione quasi atomica).
La nostra prima domanda è stata: dove si legano esattamente le poliammine per bloccare il canale TRPV3? L’inibizione da spermina dipende fortemente dal voltaggio, il che suggerirebbe un sito di legame all’interno del campo elettrico della membrana, cioè dentro il poro. Abbiamo esaminato due regioni sospette:
- Il filtro di selettività (SF): una parte stretta del poro che “sceglie” quali ioni far passare.
- Una regione carica negativamente situata proprio all’ingresso intracellulare del poro.
Per testare il ruolo del filtro di selettività, abbiamo introdotto delle piccole modifiche (mutazioni) nella sequenza aminoacidica del canale TRPV3, per renderlo più simile a quello di TRPV1 e TRPV4 in quella zona. Sorprendentemente, queste mutazioni (come la L639M o la D641N) non hanno cambiato significativamente il modo in cui la spermina bloccava il canale. Questo ci ha detto che il filtro di selettività, almeno per il blocco da poliammine intracellulari, non sembrava essere il colpevole principale.

Allora abbiamo spostato la nostra attenzione sull’altra regione candidata: l’“anello” di residui aminoacidici carichi negativamente all’imboccatura citoplasmatica del poro. Nel canale TRPV3, due residui di acido glutammico, E679 ed E682, formano questo anello. È interessante notare che TRPV1 e TRPV4 hanno solo un residuo carico negativamente in questa posizione, il che potrebbe spiegare perché la spermina blocca TRPV3 più efficacemente. L’idea era che la spermina, carica positivamente, fosse attratta da questo anello negativo.
Per verificare, abbiamo creato altre mutazioni, questa volta neutralizzando le cariche di E679 e E682 (sostituendoli con la glutammina, Q). E qui è arrivata la conferma! La mutazione E679Q ha ridotto moderatamente il blocco da spermina. La mutazione E682Q lo ha ridotto drasticamente. E quando abbiamo neutralizzato entrambi i residui (mutazione doppia E679Q/E682Q), il blocco da spermina è stato quasi completamente eliminato! Bingo! Avevamo trovato il sito di interazione chiave.
La Sorpresa della Cryo-EM: Un Canale “Attivato” ma Chiuso!
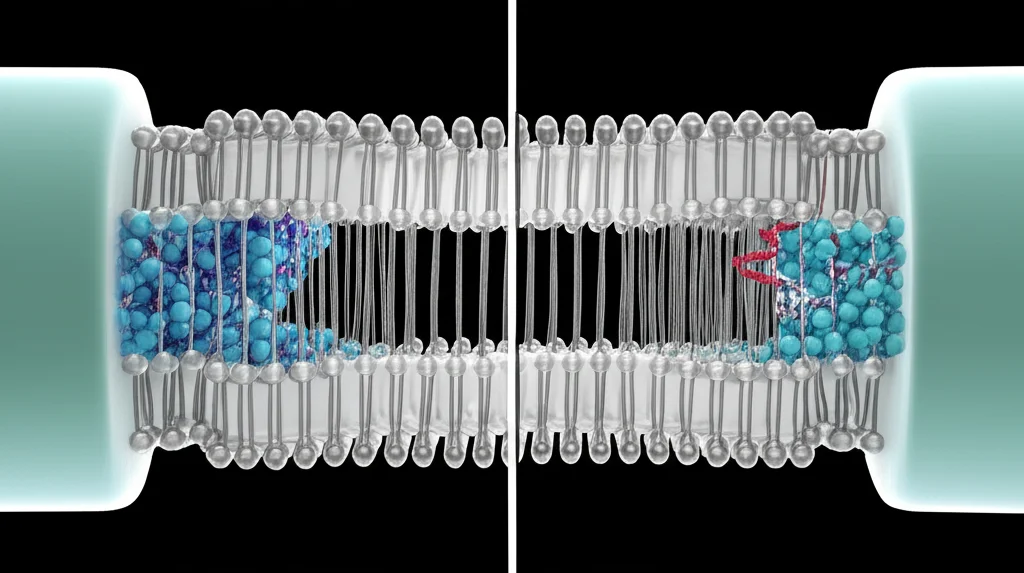
Con il sito di legame identificato, volevamo “vedere” come avviene questo blocco. Per farlo, abbiamo utilizzato la cryo-EM. Abbiamo scelto di studiare una versione mutata del canale TRPV3, chiamata K169A, che ha la particolarità di essere spontaneamente attiva e di non inattivarsi rapidamente. Questo la rende più stabile per l’analisi strutturale. Al posto della spermina, abbiamo usato un suo analogo sintetico più “ingombrante”, il NASPM, che blocca il canale in modo simile ma permea meno, sperando che rimanesse “incastrato” più facilmente per essere visualizzato.
Abbiamo quindi determinato la struttura 3D del canale TRPV3-K169A in presenza di NASPM. E qui è arrivata la vera sorpresa, un paradosso! Ci aspettavamo di vedere il NASPM comodamente alloggiato nel poro, magari bloccandolo fisicamente. Invece, non c’era traccia visibile del NASPM né dentro né fuori il poro. Ma la cosa ancora più strana era la conformazione del canale stesso: alcune parti della proteina, come un “interruttore di attivazione” situato nella regione C-terminale, erano chiaramente nella configurazione “attivata”. Eppure, il poro del canale, sia a livello del filtro di selettività (la porta superiore) sia a livello della costrizione più interna (la porta inferiore, chiamata HBC), era chiuso! Le dimensioni del poro erano simili a quelle di un canale completamente chiuso, non di uno aperto o bloccato da una molecola nel mezzo.
Come era possibile? Un interruttore di attivazione “acceso” ma con le porte del canale sbarrate? Questo era un vero rompicapo.

Un Nuovo Modello per Spiegare il Blocco
Mettendo insieme i dati di elettrofisiologia (che ci dicevano che E679 ed E682 erano cruciali per l’interazione con le poliammine) e i dati strutturali della cryo-EM (che mostravano un poro chiuso nonostante i segnali di attivazione), abbiamo dovuto elaborare un nuovo modello per spiegare il blocco da poliammine.
Ecco la nostra ipotesi: le poliammine, come la spermina o il NASPM, interagiscono con l’anello carico negativamente formato da E679 ed E682 all’ingresso citoplasmatico del poro. Questa interazione non solo impedisce fisicamente il passaggio degli ioni (blocco), ma fa qualcosa di più sottile e potente: promuove la chiusura del poro stesso, o ne impedisce l’apertura, anche se altre parti del canale sono “pronte” per l’attivazione. È come se la poliammina, legandosi, desse un segnale al canale per “serrare le porte”.
Il sollievo dal blocco, che osserviamo a voltaggi positivi, avverrebbe quando la poliammina si stacca e torna nel citoplasma, oppure, meno frequentemente, quando riesce a “sgattaiolare” attraverso il canale verso l’esterno. Questo modello riesce a conciliare sia i dati elettrofisiologici, che indicano un’interazione specifica e una dipendenza dal voltaggio, sia i dati strutturali, che mostrano un poro chiuso in presenza del bloccante.
Pensateci: è un meccanismo di regolazione elegante e inaspettato. Non un semplice “tappo” nel poro, ma un’interazione che induce un cambiamento conformazionale nel canale, portandolo a chiudersi.
Perché Tutto Questo è Importante?
Capire i meccanismi molecolari con cui i canali ionici sono regolati è fondamentale. I canali TRPV, e TRPV3 in particolare, sono implicati in sensazioni come il calore, il dolore e il prurito, e la loro iperattività è legata a diverse patologie, tra cui il dolore cronico, la sindrome di Olmsted (una rara malattia della pelle) e altre malattie dermatologiche o neurologiche. La scoperta che le poliammine endogene possono agire come potenti modulatori voltaggio-dipendenti di questi canali apre nuove prospettive.
Immaginate di poter sviluppare farmaci che mimano l’azione delle poliammine, o che ne modulano i livelli intracellulari, per “calmare” i canali TRPV iperattivi. Questo potrebbe portare a nuove strategie terapeutiche per trattare il dolore, il prurito cronico o altre condizioni legate a una disfunzione di questi canali. La natura, ancora una volta, ci mostra meccanismi di controllo incredibilmente sofisticati che possiamo imparare a sfruttare per il nostro benessere.
Il nostro viaggio nel mondo delle poliammine e dei canali TRPV3 ci ha svelato un meccanismo di blocco affascinante e più complesso di quanto immaginassimo. È la bellezza della ricerca scientifica: partire da un’osservazione, formulare ipotesi, testarle con esperimenti ingegnosi e, a volte, imbattersi in sorprese che ci costringono a ripensare i nostri modelli e ad ampliare la nostra comprensione del meraviglioso libro della vita. E chissà quali altre scoperte ci aspettano dietro l’angolo!
Fonte: Springer