Cancro al Seno: E Se la Chiave Fosse Bloccare gli Ormoni “Nascosti”?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nella lotta contro una delle forme più aggressive di cancro al seno, il cosiddetto triplo negativo (TNBC). Sapete, il cancro al seno è ancora una sfida enorme, la seconda causa di morte per cancro nelle donne a livello globale. E il TNBC è particolarmente ostico perché non risponde alle terapie ormonali classiche o ai farmaci mirati come altri tipi.
Negli ultimi anni, l’immunoterapia ha rappresentato una vera rivoluzione, un po’ come dare al nostro sistema immunitario le armi giuste per riconoscere e attaccare il tumore. Però, diciamocelo, nel caso del TNBC i risultati non sono stati sempre all’altezza delle aspettative. Perché? Beh, sembra che questo tipo di tumore sia un maestro nel creare attorno a sé una specie di “scudo”, un microambiente tumorale (TME) che spegne le nostre difese immunitarie.
Lo scudo invisibile del TNBC
Immaginate il TME come un campo di battaglia dove le cellule tumorali reclutano “alleati” sbagliati. Tra questi ci sono i macrofagi associati al tumore (TAM), che invece di attaccare il nemico, lo aiutano a crescere e diffondersi, e i linfociti T regolatori (Tregs), che mettono letteralmente i freni alle altre cellule immunitarie combattenti (i linfociti T CD4+ e CD8+). Anche le cellule dendritiche (DC), che normalmente sono bravissime ad attivare la risposta immunitaria, in questo ambiente diventano inefficienti, quasi “tolleranti” verso il tumore. Insomma, un bel pasticcio che impedisce al nostro esercito interno di fare il suo lavoro. La domanda è: cosa rende questo TME così ostile alle nostre difese?
Una scoperta inaspettata: gli steroidi “fatti in casa”
Qui entra in gioco la nostra ricerca. Abbiamo iniziato a sospettare che ci fosse un attore nascosto in questa dinamica: gli ormoni steroidei. Normalmente pensiamo alla produzione di steroidi (la steroidogenesi) come a qualcosa che avviene nelle ghiandole surrenali o nelle gonadi. Ma negli ultimi anni si è scoperto che anche altri tessuti, e persino alcune cellule immunitarie, possono produrre steroidi “in loco”, un fenomeno chiamato steroidogenesi extra-ghiandolare. E indovinate un po’? Questi steroidi locali spesso hanno un ruolo nel calmare l’infiammazione e mantenere l’equilibrio (omeostasi) nei tessuti.
Studi precedenti, anche nel nostro laboratorio, avevano già mostrato che in altri tumori, come il melanoma e il carcinoma del colon, le cellule immunitarie all’interno del TME potevano produrre steroidi autonomamente, e questo processo sembrava indebolire la risposta anti-tumorale, in particolare quella dei potenti linfociti T CD8+. Ci siamo chiesti: potrebbe succedere la stessa cosa nel TNBC, noto per le sue forti reazioni immunitarie soppressive?
Gli steroidi, in particolare i glucocorticoidi (GC), sono noti per la loro capacità di regolare il sistema immunitario. Possono “spegnere” i macrofagi pro-infiammatori (quelli buoni, tipo M1) e favorire quelli anti-infiammatori (tipo M2, che spesso aiutano il tumore). Possono anche rendere le cellule dendritiche più “tolleranti”, incapaci di attivare una risposta immunitaria efficace. È interessante notare che, mentre molti tumori al seno rispondono agli estrogeni e al progesterone, il TNBC non lo fa. Tuttavia, risponde ai glucocorticoidi! Anzi, alti livelli del recettore per i glucocorticoidi (GR) nel TNBC sono spesso associati a resistenza alla chemioterapia e a una prognosi peggiore.
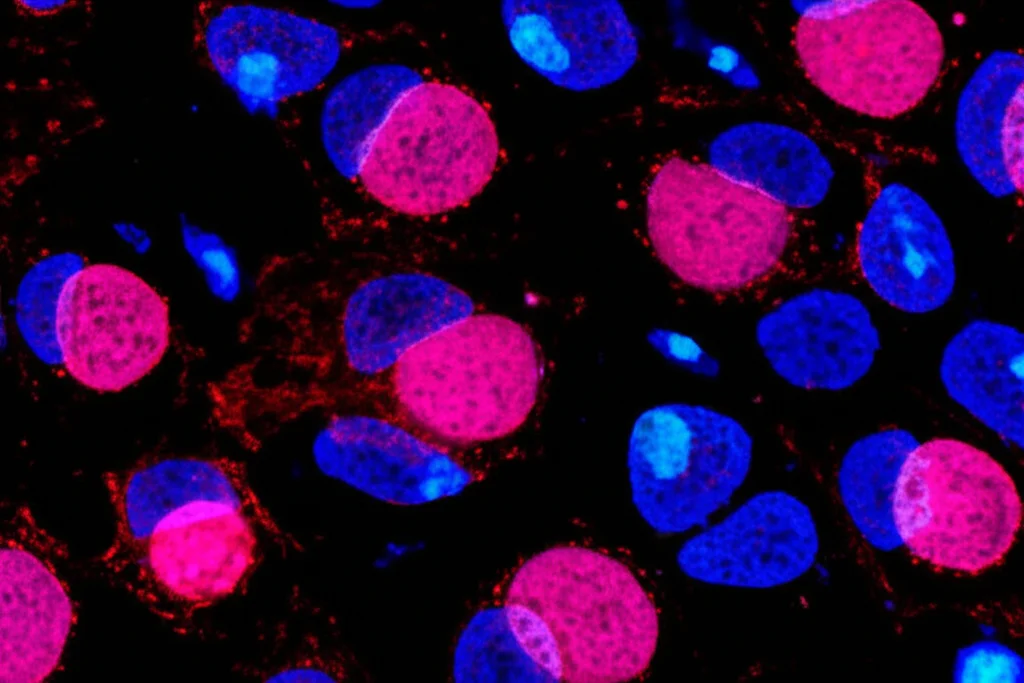
Indagare nel cuore del tumore
Armati di queste conoscenze, abbiamo deciso di andare a vedere cosa succedeva direttamente nei tumori TNBC umani, prelevati da pazienti che non avevano ancora iniziato alcuna terapia (un dettaglio importante per non avere dati “inquinati”). Utilizzando tecniche super sofisticate come la spettrometria di massa (LC-MS/MS), abbiamo letteralmente “profilato” gli steroidi presenti. E sorpresa! Abbiamo trovato ben 31 tipi diversi di steroidi, con due protagonisti principali: il cortisolo (un glucocorticoide) e il deidroepiandrosterone (un androgeno). Analizzando poi i dati genetici (RNA-seq) di centinaia di pazienti TNBC, abbiamo visto che il recettore per i glucocorticoidi (NR3C1) era espresso a livelli molto alti.
Integrando i dati sulla concentrazione degli steroidi con quelli sull’espressione dei geni e dei recettori, abbiamo capito che i corticosteroidi, e il cortisolo in particolare, sembravano avere il ruolo più influente nel TME del TNBC. Non solo: l’espressione dei recettori per glucocorticoidi, androgeni e progestinici era inversamente correlata alla presenza di cellule immunitarie “buone” (DC attivate, macrofagi M1) e positivamente correlata a cellule “cattive” o “spente” (mastociti a riposo, DC a riposo, macrofagi M2). Un chiaro indizio del loro ruolo inibitorio.
Ma chi produceva questi steroidi direttamente nel tumore? Analizzando le sezioni di tessuto tumorale con tecniche di colorazione (IHC e IF), abbiamo localizzato l’enzima chiave della steroidogenesi, il CYP11A1 (quello che dà il via a tutto il processo partendo dal colesterolo). E dove si trovava principalmente? Proprio nelle aree ricche di cellule immunitarie infiltranti! Analisi a livello di singola cellula (scRNA-seq) hanno confermato che le cellule immunitarie nel tumore erano molto più “attrezzate” per la steroidogenesi rispetto a quelle circolanti nel sangue. Era la prova che cercavamo: una steroidogenesi immunitaria locale era attiva nel TME del TNBC.
Bloccare la produzione locale: l’esperimento chiave
A questo punto, l’ipotesi era chiara: se le cellule immunitarie producono steroidi immunosoppressivi (come i glucocorticoidi) direttamente nel tumore, e questo aiuta il cancro a sfuggire alle difese, cosa succederebbe se bloccassimo questa produzione locale?
Per verificarlo, abbiamo creato un modello murino speciale. Utilizzando tecniche di ingegneria genetica, abbiamo “spento” il gene Cyp11a1 specificamente in tutte le cellule del sistema immunitario (usando un sistema chiamato Cre-Lox con Vav1Cre). In questi topi, chiamiamoli Cyp11a1cKO, le cellule immunitarie non potevano più iniziare la steroidogenesi. Abbiamo quindi impiantato cellule di TNBC murino (E0771.LMB) in questi topi e nei topi di controllo.
I risultati sono stati netti: nei topi Cyp11a1cKO, la crescita del tumore era significativamente rallentata rispetto ai controlli! E, come previsto, nei tumori di questi topi i livelli di steroidi prodotti localmente erano quasi azzerati. È importante notare che i livelli di steroidi nel sangue non cambiavano, a dimostrazione che stavamo agendo solo sulla produzione locale nel TME.

Analizzando le cellule immunitarie all’interno dei tumori con scRNA-seq, abbiamo visto cambiamenti notevoli. Nei topi Cyp11a1cKO c’era una riduzione significativa dei macrofagi (soprattutto quelli M2 pro-tumorali) e un aumento dei macrofagi M1 anti-tumorali. Anche se la popolazione totale di linfociti T non cambiava drasticamente, vedevamo meno Tregs immunosoppressori e meno linfociti T CD8+ “stanchi” (che esprimono PD-1). Insomma, bloccare la steroidogenesi immunitaria sembrava proprio “risvegliare” la risposta anti-tumorale.
Il ruolo chiave dei glucocorticoidi (e come contrastarli)
Ma quale via di segnalazione specifica stavamo interrompendo? Le analisi scRNA-seq hanno confermato che il recettore dei glucocorticoidi (NR3C1) era il più espresso nelle cellule immunitarie tumorali, sia umane che murine. E nei topi Cyp11a1cKO, l’espressione di geni indotti dai glucocorticoidi, come Tsc22d3 (noto anche come GILZ, un potente immunosoppressore), era significativamente ridotta, specialmente nelle cellule dendritiche. Al contrario, geni importanti per la funzione delle DC (come Cd44) erano aumentati.
Per confermare il ruolo diretto dei GC, abbiamo fatto esperimenti in vitro con cellule dendritiche umane. Trattandole con cortisolo, abbiamo visto che diventavano meno capaci di stimolare la risposta immunitaria: producevano meno molecole co-stimolatorie (come CD86) e meno citochine pro-infiammatorie (IL-12, IL-6), mentre aumentavano quelle immunosoppressive (TGF-β, IL-10). Quando queste DC “trattate” venivano messe a contatto con linfociti T, questi ultimi diventavano meno attivi e producevano meno IFNγ e TNFα (citochine chiave per l’attacco al tumore).
La cosa fantastica è che, nei nostri topi Cyp11a1cKO, l’inibizione della steroidogenesi contrastava proprio questi effetti indotti dai GC! Le DC nei loro tumori erano più mature, meno “tolleranti” (producevano meno IL-10 e TGF-β), e i linfociti T CD8+ erano più attivi e meno “esausti”, producendo più IFNγ e TNFα. Era la conferma: bloccando la produzione locale di steroidi, stavamo interrompendo la segnalazione immunosoppressiva dei glucocorticoidi e rinvigorendo l’immunità anti-tumorale.
Chi sono i “colpevoli”? Identificare le cellule produttrici
Ma quali cellule immunitarie erano le principali responsabili di questa steroidogenesi nel TME del TNBC? Per scoprirlo, abbiamo usato un altro modello murino ingegnoso: topi “reporter” in cui le cellule che esprimevano Cyp11a1 producevano anche una proteina fluorescente (mCherry). Dopo aver impiantato il tumore, abbiamo isolato le cellule immunitarie fluorescenti (mCherry+) e non fluorescenti (mCherry-) dal TME e le abbiamo analizzate con scRNA-seq.
I risultati hanno indicato che le cellule steroidogeniche (mCherry+) erano prevalentemente macrofagi, mastociti e basofili. Utilizzando un’analisi metabolica a livello di singola cellula (scFBA), abbiamo visto che mastociti e basofili mostravano un flusso metabolico particolarmente elevato nella conversione del colesterolo a pregnenolone (il primo passo della steroidogenesi) e nella produzione di steroidi a valle, come il corticosterone. Anche nei dati umani (anche se mancavano i basofili), i mastociti emergevano come attori importanti. Curiosamente, un’alta presenza di mastociti insieme a un’alta espressione di CYP11A1 nei tumori al seno umani era associata a una peggiore sopravvivenza. I mastociti, noti per le allergie, si rivelavano quindi come inaspettati protagonisti nella produzione di steroidi immunosoppressivi nel TNBC!

Una possibile soluzione farmacologica: il Posaconazolo
Avere identificato il meccanismo e le cellule chiave è fantastico, ma la vera sfida è tradurre tutto questo in una terapia. Potevamo bloccare farmacologicamente l’enzima CYP11A1? Uno studio parallelo di “riposizionamento” di farmaci (drug repurposing) ha puntato i riflettori su un candidato interessante: il posaconazolo. Si tratta di un farmaco antifungino già ampiamente utilizzato e con un profilo di sicurezza noto. Testandolo in vitro su mastociti, abbiamo visto che il posaconazolo riduceva efficacemente la produzione di pregnenolone (il prodotto di CYP11A1) senza essere tossico per le cellule.
Era il momento della prova del nove: funzionava anche in vivo? Abbiamo trattato topi con tumore TNBC (sia il modello E0771.LMB che un altro, E0771) con posaconazolo per via orale. I risultati sono stati entusiasmanti: il trattamento con posaconazolo ha significativamente inibito la crescita tumorale! Analizzando i tumori trattati, abbiamo visto un aumento delle cellule immunitarie “buone” e un incremento dei linfociti T CD8+ citotossici (quelli che producono IFNγ e TNFα).
Verso la clinica: il test nel modello umanizzato
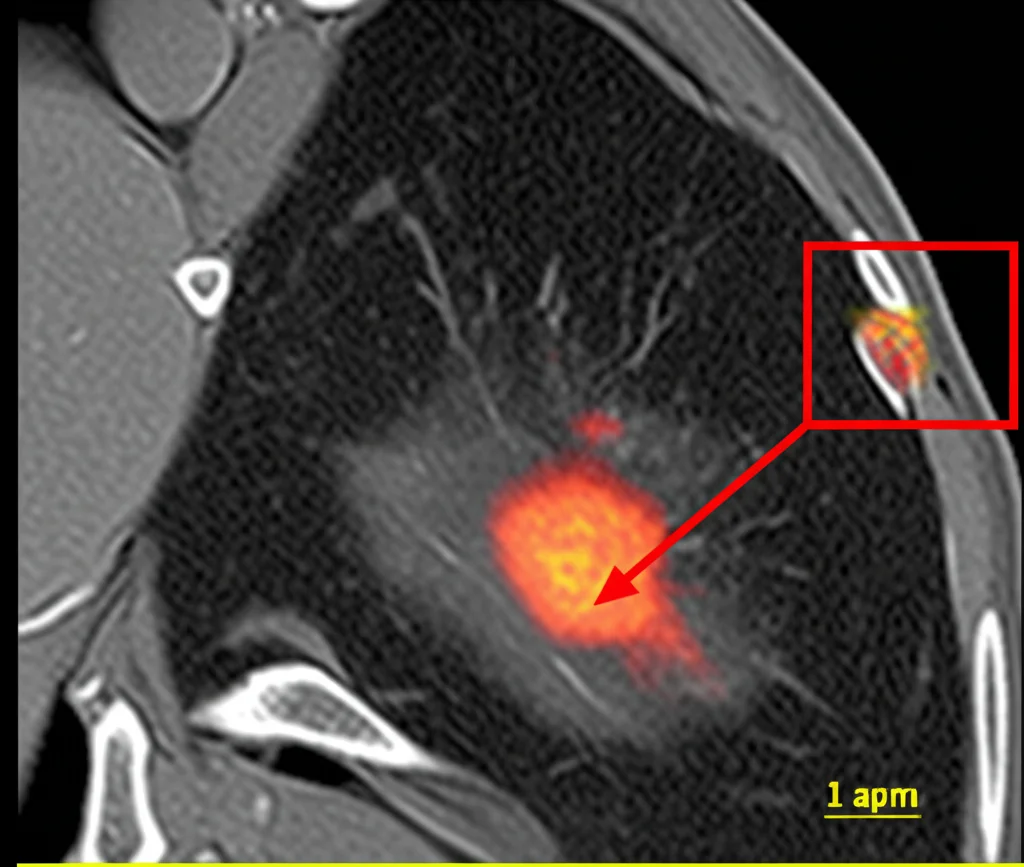
Per rendere i risultati ancora più rilevanti per l’uomo, abbiamo utilizzato un modello murino “umanizzato” (huPBMC-NOG-dKO). In questi topi, che hanno un sistema immunitario parzialmente umano, abbiamo impiantato cellule di TNBC umano (MDA-MB-231) direttamente nel cuscinetto adiposo mammario (impianto ortotopico). Abbiamo poi trattato i topi con posaconazolo.
Monitorando la crescita tumorale con la risonanza magnetica (MRI), abbiamo osservato una marcata riduzione del volume tumorale nei topi trattati con posaconazolo già dopo una settimana. Alla fine dell’esperimento (21 giorni), i tumori nei topi trattati erano significativamente più piccoli. È importante sottolineare che il farmaco è stato ben tollerato, senza effetti collaterali evidenti. Le analisi genetiche (RNA-seq) dei tumori trattati hanno mostrato un potenziamento delle risposte immunitarie mediate da IFNγ e TNFα.
Conclusioni e prospettive future
Quindi, cosa ci dice tutto questo? Abbiamo scoperto un meccanismo affascinante e finora poco esplorato attraverso cui il TNBC si difende dal sistema immunitario: la produzione locale di steroidi immunosoppressivi da parte delle stesse cellule immunitarie infiltrate nel tumore, in particolare macrofagi, mastociti e basofili. Questa steroidogenesi locale, guidata dall’enzima CYP11A1, porta alla produzione di glucocorticoidi che “spengono” le cellule dendritiche e i linfociti T, favorendo la crescita tumorale.
La notizia entusiasmante è che abbiamo dimostrato, sia geneticamente che farmacologicamente, che inibire questo processo può riattivare la risposta immunitaria anti-tumorale e frenare la progressione del TNBC. L’identificazione del posaconazolo, un farmaco già esistente, come inibitore efficace di CYP11A1 in questo contesto apre prospettive terapeutiche concrete e potenzialmente rapide.
Certo, la strada verso l’applicazione clinica richiede ulteriori studi e trial clinici rigorosi per confermare l’efficacia e la sicurezza nell’uomo, magari anche in combinazione con altre terapie come l’immunoterapia. Ma i risultati preclinici sono estremamente promettenti. Aver svelato questa intricata interazione tra steroidi e immunità nel TME del TNBC non solo ci aiuta a capire meglio la biologia di questo tumore aggressivo, ma ci offre anche un nuovo bersaglio terapeutico. Chissà, forse bloccare questi ormoni “nascosti” potrebbe davvero rappresentare una nuova arma nella lotta contro il cancro al seno triplo negativo. Staremo a vedere!
Fonte: Springer







