Cateteri Urinari: Un Mondo Nascosto di Microbi in Lotta e Cooperazione Sotto Flusso!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante, quasi invisibile, ma che riguarda da vicino la salute di molti pazienti ospedalizzati: il mondo dei microbi che colonizzano i cateteri urinari. Sembra un argomento un po’ tecnico, vero? Ma aspettate di sentire cosa abbiamo scoperto! È una storia di comunità complesse, alleanze inaspettate e battaglie silenziose che avvengono proprio lì, su quei tubicini di plastica.
L’inizio della nostra curiosità: cosa c’è davvero sui cateteri?
Partiamo da un dato di fatto: le infezioni del tratto urinario associate all’uso di cateteri (le famose CAUTI, dall’inglese Catheter-Associated Urinary Tract Infections) sono tra le infezioni ospedaliere più comuni. Un bel problema, no? Per anni, la ricerca si è concentrata molto sui singoli “cattivi”, un batterio o un fungo alla volta. Ma la realtà, come spesso accade, è molto più intricata. Ci siamo chiesti: e se questi microbi non amassero la solitudine? Se preferissero fare “gruppo”?
Così, abbiamo iniziato a raccogliere campioni di cateteri urinari rimossi da pazienti in terapia intensiva. Volevamo vedere con i nostri occhi chi fossero gli inquilini di questi dispositivi. Armati di piastre di coltura e microscopi, abbiamo iniziato la nostra indagine.
La sorpresa: non uno, ma tanti! E alcuni giocano a nascondino…
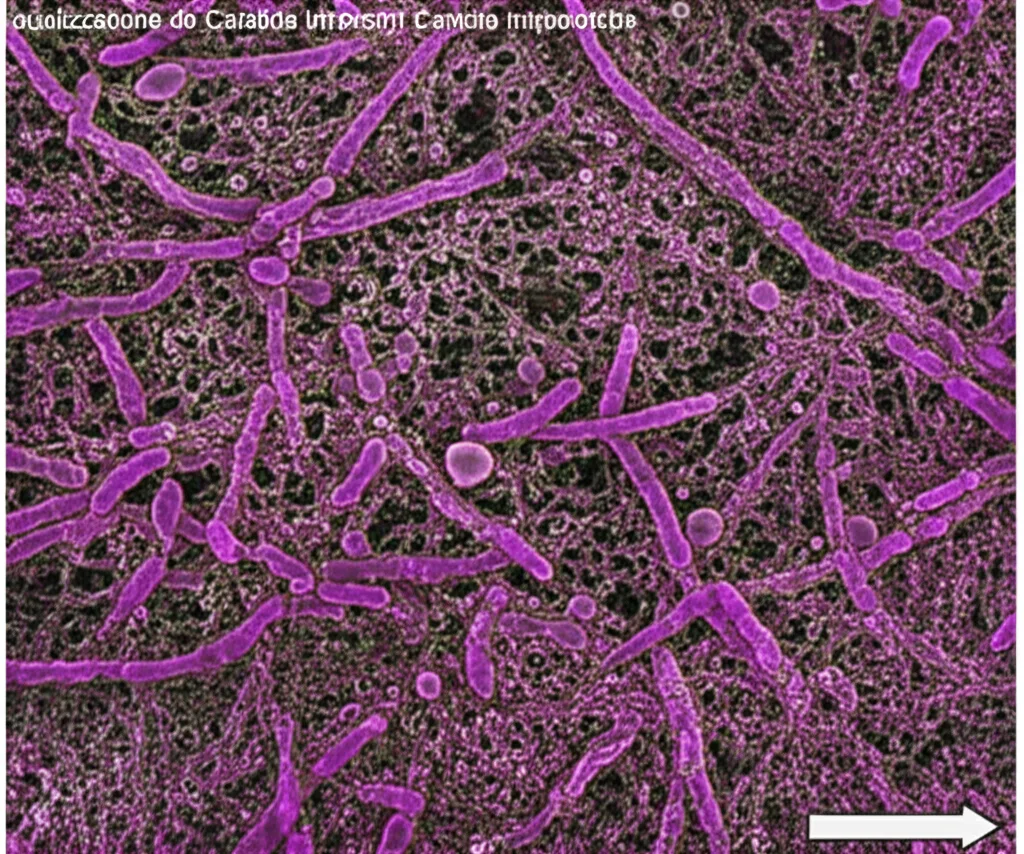
I primi risultati sono stati subito chiari: la maggior parte dei cateteri non era colonizzata da una sola specie, ma da un vero e proprio “condominio” microbico! Abbiamo trovato spesso biofilm polimicrobici, cioè quelle pellicole biologiche complesse formate da più specie diverse, in particolare una combinazione di batteri e funghi del genere Candida (come la famosa C. albicans o la meno studiata ma importante C. tropicalis). Immaginate una sorta di città microscopica adesa alla superficie del catetere.
Ma la vera sorpresa è arrivata quando abbiamo usato una tecnica più potente, la metagenomica, che legge direttamente il DNA presente nel campione, senza bisogno di far crescere i microbi in laboratorio. Ebbene, abbiamo scoperto un universo ancora più vasto! La metagenomica ci ha rivelato la presenza di molte più specie di quelle che riuscivamo a coltivare. Alcuni microbi, pur essendo abbondanti nel campione (come un certo Acinetobacter baumannii, un “superbatterio” piuttosto temuto), semplicemente non ne volevano sapere di crescere sulle nostre piastre. Erano lì, ma in uno stato “dormiente” o non coltivabile. Questo ci ha fatto capire quanto sia complessa e in parte ancora misteriosa la composizione di queste comunità.
![]()
Più forti insieme: il potere dei biofilm polimicrobici
Una volta identificati i principali attori (quelli coltivabili almeno!), abbiamo voluto capire come interagissero tra loro. Abbiamo selezionato alcune combinazioni comuni trovate sui cateteri, come Candida albicans o Candida tropicalis insieme a batteri come Klebsiella pneumoniae, Pseudomonas aeruginosa o Escherichia coli, e le abbiamo fatte crescere insieme in laboratorio per formare biofilm.
Usando un test semplice ma efficace (il saggio con cristalvioletto, che colora il biofilm), abbiamo misurato quanto “forte” fosse l’adesione di questi biofilm alle superfici. Il risultato? I biofilm formati da più specie (polimicrobici) erano significativamente più forti e più aderenti rispetto a quelli formati da una sola specie. È come se stando insieme, questi microbi riuscissero a costruire una “fortezza” più resistente. Questo ha implicazioni importanti: un biofilm più tenace è più difficile da rimuovere e può resistere meglio agli antibiotici o alle difese del nostro corpo.
Simulare la realtà: l’importanza del flusso
C’è un però. Far crescere i microbi in una piastrina ferma (condizione statica) è comodo, ma non rispecchia esattamente quello che succede in un catetere urinario, dove l’urina scorre continuamente. Questo flusso crea un ambiente dinamico, con forze meccaniche (shear stress) e un ricambio costante di nutrienti. Come si comportano i nostri biofilm in queste condizioni più realistiche?
Per scoprirlo, abbiamo costruito un sistema di flusso in laboratorio. Abbiamo usato delle speciali “slide” con dei piccoli canali (ibidi µ-slide) attraverso cui facevamo scorrere continuamente un terreno di coltura liquido, simulando il flusso dell’urina. Abbiamo fatto crescere i nostri biofilm, sia quelli singoli che quelli misti, dentro questi canali per 72 ore.

Sotto flusso è diverso: architettura, spessore e vitalità cambiano!
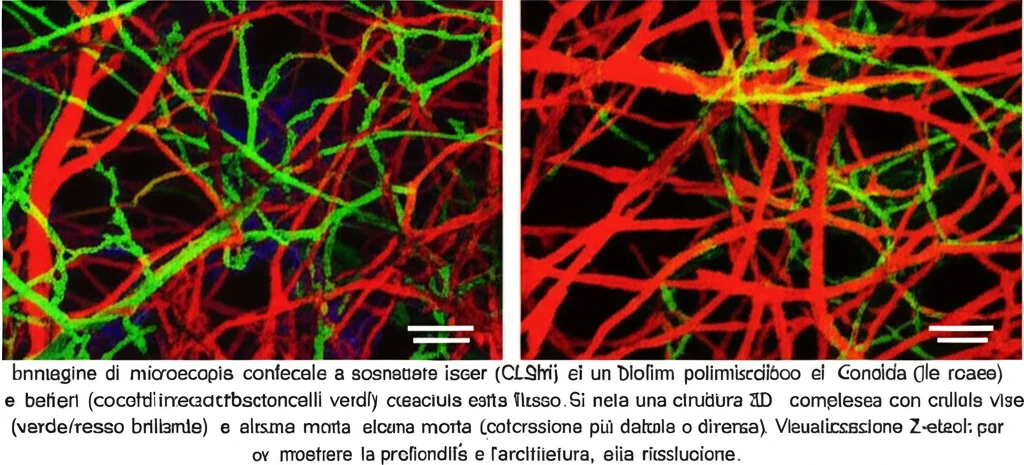
E qui le cose si sono fatte ancora più interessanti! Osservando i biofilm al microscopio confocale (uno strumento potentissimo che permette di vedere la struttura tridimensionale e distinguere le cellule vive da quelle morte), abbiamo notato differenze significative tra le condizioni statiche e quelle di flusso.
Sotto flusso:
- L’architettura del biofilm era spesso diversa: a volte più uniforme, altre volte più densa.
- Lo spessore del biofilm tendeva ad aumentare, specialmente per i biofilm polimicrobici. Il “campione” di spessore è stato il biofilm di Pseudomonas aeruginosa da solo, che sotto flusso è diventato notevolmente più spesso!
- La vitalità era generalmente maggiore: c’erano molte più cellule vive rispetto alle condizioni statiche. Il flusso costante sembrava “mantenere in forma” la comunità microbica.
Abbiamo anche osservato comportamenti specifici affascinanti. Ad esempio, le cellule di E. coli, sotto flusso, a volte si allungavano! E le interazioni tra specie cambiavano.
Alleanze e antagonismi: Candida e Co. sotto i riflettori
Studiando le combinazioni Candida-batteri sotto flusso, abbiamo notato dinamiche particolari:
* Candida albicans sembra fare da “buona vicina”: Nelle combinazioni con K. pneumoniae, P. aeruginosa ed E. coli, la sua presenza sembrava favorire la sopravvivenza delle cellule batteriche nel biofilm sotto flusso. Una sorta di sinergia.
* Candida tropicalis, invece, mostra un lato più “aggressivo”: In combinazione con K. pneumoniae ed E. coli, la popolazione di questi batteri diminuiva drasticamente, quasi come se C. tropicalis li eliminasse attivamente (antagonismo). Curiosamente, con P. aeruginosa, questa dinamica non era così evidente, suggerendo un’interazione diversa.
Queste scoperte sono cruciali. Capire chi “collabora” e chi “combatte” all’interno del biofilm, e come queste interazioni cambiano in condizioni realistiche di flusso, ci dà indizi preziosi su come queste infezioni si sviluppano e persistono.
Perché tutto questo è importante?
Potreste chiedervi: “Ok, interessante, ma a cosa serve sapere tutto ciò?”. Serve eccome! Le infezioni polimicrobiche sono spesso più difficili da trattare rispetto a quelle causate da un singolo microbo. I biofilm, specialmente quelli misti e ben strutturati come quelli che abbiamo visto sotto flusso, sono notoriamente resistenti agli antibiotici.
Comprendere la composizione esatta di queste comunità (inclusi i membri “nascosti” rilevati dalla metagenomica) e le dinamiche interne (chi aiuta chi, chi ostacola chi, come il flusso influenza tutto) è fondamentale per sviluppare nuove strategie. Potremmo pensare a terapie mirate che non cercano solo di uccidere tutti indiscriminatamente, ma magari di “rompere” le alleanze microbiche, di disturbare la struttura del biofilm o di rendere i microbi più vulnerabili ai farmaci esistenti.
Il nostro studio mette in luce la complessità nascosta sui dispositivi medici comuni come i cateteri urinari. Non si tratta solo di singoli invasori, ma di ecosistemi microbici dinamici e interattivi. La prossima volta che sentirete parlare di infezioni ospedaliere, pensate a queste minuscole città microbiche e alle intricate relazioni che le governano. C’è ancora tanto da scoprire, ma ogni passo avanti nella comprensione ci avvicina a soluzioni più efficaci per proteggere la salute dei pazienti.
Fonte: Springer