Benzalconio Cloruro: La Rivoluzione Nascosta per lo Stoccaggio del Gas Naturale!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio parlarvi di una cosa che potrebbe sembrarvi uscita da un film di fantascienza, ma che invece è attualissima e super interessante: come immagazzinare il gas naturale in modo più efficiente. E no, non sto parlando di bombole più grandi, ma di una tecnica che sfrutta… il ghiaccio! O meglio, qualcosa di molto simile. E il protagonista di questa storia? Un composto dal nome un po’ ostico, il Benzalconio Cloruro (Bzc), che si sta rivelando un vero asso nella manica.
Ma cosa sono questi famosi Idrati di Gas Naturale?
Immaginatevi delle microscopiche gabbiette fatte di molecole d’acqua, che al loro interno intrappolano molecole di gas, come il metano. Ecco, questi sono gli idrati di gas naturale (NGH). Sembrano ghiaccio, ma se li avvicinate a una fiamma… bruciano! Questo perché il gas è lì, pronto per essere liberato. L’idea di usare gli idrati per immagazzinare e trasportare il gas naturale è geniale: si può stipare una quantità enorme di gas in un volume relativamente piccolo, e in modo più sicuro rispetto al gas liquefatto. Pensate, un metro cubo di idrato può contenere fino a 160-180 metri cubi di gas! Mica male, eh?
Il Problema: Formazione Lenta e Condizioni Difficili
Tutto bellissimo, se non fosse che formare questi idrati non è proprio una passeggiata. Richiedono alta pressione e basse temperature, e spesso il processo è lento, lentissimo. È un po’ come aspettare che l’acqua geli in freezer, ma con molte più complicazioni. E qui entrano in gioco i nostri “aiutanti chimici”.
I Promotori: Un Piccolo Aiuto per Grandi Risultati
Per dare una spintarella alla formazione degli idrati, gli scienziati usano delle sostanze chiamate promotori. Alcuni, come il tetraidrofurano (THF), sono “termodinamici”, cioè rendono più facili le condizioni di pressione e temperatura. Altri, come i tensioattivi, sono “cinetici”, cioè accelerano la velocità con cui si formano gli idrati. Tra questi, il Sodio Dodecilsolfato (SDS) è stato per anni una specie di campione in carica. L’SDS è un tensioattivo anionico (cioè la sua “testa” attiva ha carica negativa) molto usato, che aiuta a “mescolare” meglio acqua e gas, facilitando la creazione delle gabbiette di idrato. Ma si può fare di meglio? Sembra proprio di sì!
Benzalconio Cloruro (Bzc): Il Nuovo Campione all’Orizzonte?
Ed eccoci al nostro protagonista: il Benzalconio Cloruro. Se l’SDS è un veterano, il Bzc è la giovane promessa che sta sbaragliando la concorrenza. Il Bzc è un sale d’ammonio quaternario (QAS), una classe di composti che si sta rivelando fenomenale per gli idrati. Questi QAS sono un po’ dei tuttofare: abbassano la tensione superficiale tra acqua e gas (immaginate che rendano l’acqua “più accogliente” per il gas), aumentano la disponibilità di molecole di gas vicino a dove si formerà l’idrato e stabilizzano i primi “nuclei” di idrato che si formano.
Studi recenti, come quello che sto per raccontarvi, hanno messo a confronto il Bzc con l’acqua pura e con il buon vecchio SDS. E i risultati sono stati, a dir poco, sorprendenti!
Si è visto che il Bzc, usato in concentrazioni tra 500 e 3000 ppm (parti per milione), non solo accelera tantissimo la formazione degli idrati, ma riduce anche drasticamente il cosiddetto “tempo di induzione”. Cos’è? È il tempo che passa da quando creiamo le condizioni giuste a quando effettivamente iniziano a formarsi i primi cristalli di idrato. Beh, con 2500 ppm di Bzc, questo tempo si è ridotto a soli 9,9 minuti, contro i 41,3 minuti dell’SDS! Un bel guadagno di tempo, non trovate?
Ma non è finita qui. Il Bzc sembra anche migliorare la quantità di gas che riusciamo a “catturare” nell’idrato. E quando arriva il momento di liberare il gas, la dissociazione dell’idrato con Bzc è più fluida e veloce rispetto a quella con SDS. Insomma, il Bzc sembra rendere tutto il processo più efficiente, sia in formazione che in “scioglimento”.
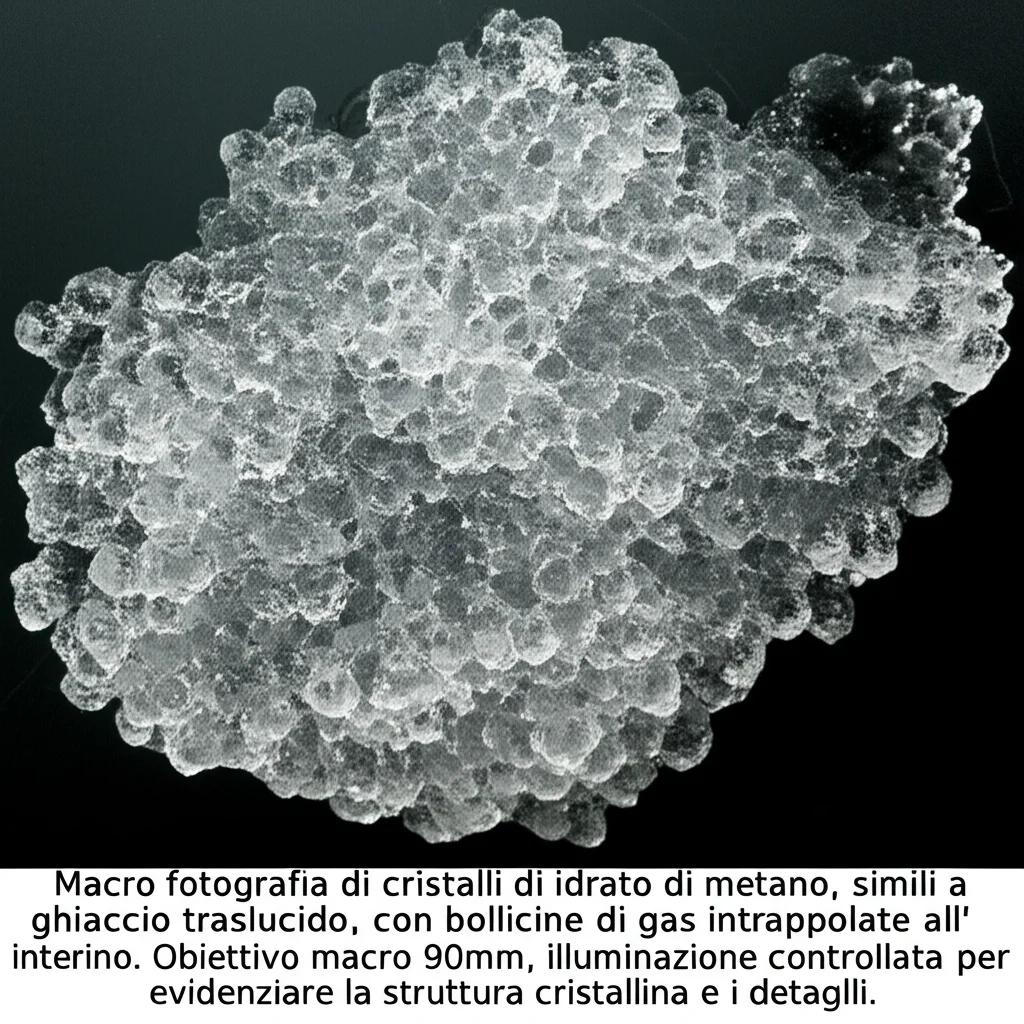
Come Funziona la Magia del Bzc?
Vi chiederete: ma qual è il segreto del Bzc? Gli scienziati hanno indagato misurando cose come il potenziale zeta e la tensione superficiale. Il potenziale zeta ci dà un’idea della stabilità delle molecole di tensioattivo in soluzione. Più è alto (in valore assoluto), meglio è. E il Bzc ha mostrato un potenziale zeta più elevato dell’SDS. Inoltre, il Bzc raggiunge la sua “concentrazione micellare critica” (CMC) – il punto in cui le molecole di tensioattivo iniziano ad aggregarsi formando delle “micelle” che aiutano il processo – prima e a una tensione superficiale più bassa rispetto all’SDS. Questo significa che è più efficiente nel suo lavoro.
Un altro aspetto cruciale sembra essere la distribuzione delle cariche elettroniche sulla molecola di Bzc. I calcoli hanno mostrato che il Bzc ha una carica netta negativa più alta sull’atomo di ossigeno coinvolto rispetto all’SDS. Questa caratteristica elettronica potrebbe essere la chiave della sua superiore capacità di promuovere la formazione degli idrati, minimizzare i tempi di attesa e massimizzare il recupero del gas.
Quando si formano gli idrati in presenza di Bzc, si è visto che si crea una struttura cristallina chiamata sII (struttura II), che è particolarmente adatta per questo tipo di “ospiti” gassosi. La formazione inizia all’interfaccia tra gas e liquido e poi si propaga sia verso l’alto, nella fase gassosa, sia verso il basso, nel liquido.
Gli Esperimenti: Bzc alla Prova dei Fatti
Per arrivare a queste conclusioni, i ricercatori hanno usato un’apparecchiatura sofisticata: un cristallizzatore ad alta pressione (fino a 10 megapascal!), resistente alla corrosione, con un sistema di controllo della temperatura precisissimo e agitatori magnetici per mescolare bene il tutto. Hanno condotto due tipi di esperimenti: test sulla zona di stabilità dell’idrato (per capire a quali pressioni e temperature l’idrato è stabile) e studi sulla cinetica (per vedere quanto velocemente si forma).
Hanno iniziato con acqua pura, poi hanno aggiunto Bzc a diverse concentrazioni (500, 1000, 1500, 2500 ppm) e SDS (a 600 ppm, una concentrazione nota per la sua efficacia). Le condizioni iniziali erano 6.5 MPa e una temperatura di circa 0°C (273.15 K).
I risultati parlano chiaro: mentre l’SDS non cambiava molto le condizioni di equilibrio pressione-temperatura rispetto all’acqua pura, l’aggiunta di Bzc spostava l’equilibrio verso temperature più alte (fino a +8.6 K a parità di pressione) e pressioni più basse. Per esempio, a 4.6 MPa, con il Bzc l’idrato era stabile a 295.9 K (circa 22.7°C!), mentre con l’acqua pura servivano condizioni ben più severe. Questo significa che il Bzc agisce come un promotore termodinamico, rendendo la formazione degli idrati possibile in condizioni meno “estreme” e quindi, potenzialmente, meno costose.

Più Gas, Più in Fretta: I Vantaggi Cinetici
Oltre a facilitare le condizioni, il Bzc, come dicevamo, accelera il processo. Il tempo di induzione, quel periodo di attesa prima che la festa inizi, è stato il più basso con 2500 ppm di Bzc: solo 9.9 minuti. Con l’SDS era di 41.3 minuti, e con l’acqua pura addirittura 49 minuti!
E il consumo di gas? Cioè, quanto gas riusciamo a intrappolare? Anche qui, il Bzc a 2500 ppm ha mostrato un consumo di gas per mole d’acqua molto elevato, paragonabile a quello dell’SDS a 600 ppm, ma con tutti i vantaggi di velocità e condizioni migliori. Nelle prime tre ore, il sistema con SDS è partito forte, seguito da Bzc a 2500 ppm, ma alla fine dei test (24 ore), entrambi avevano “mangiato” una quantità simile di gas.
Infine, il recupero del gas. Quando si è trattato di “smontare” gli idrati per liberare il gas, il sistema con Bzc ha permesso un recupero del 98.56% del gas, contro il 95.38% dell’SDS, e lo ha fatto anche più velocemente.
Perché Tutto Questo è Così Importante?
Beh, immaginate le implicazioni! Poter formare idrati di gas naturale più velocemente, a pressioni più basse e temperature più alte, e con un recupero del gas quasi totale, significa rendere questa tecnologia di stoccaggio e trasporto molto più praticabile ed economicamente vantaggiosa. Potrebbe rivoluzionare il modo in cui gestiamo una delle nostre risorse energetiche più importanti. Non solo per lo stoccaggio e il trasporto, ma anche per altre applicazioni come la separazione dei gas, la cattura della CO2 (un altro tema caldissimo!) e persino la desalinizzazione dell’acqua marina.
Il Benzalconio Cloruro, questo composto che magari fino a poco fa non avevate mai sentito nominare, si sta dimostrando un piccolo gigante, capace di aprire nuove strade nel campo dell’energia. Certo, la ricerca è ancora in corso, e ci sono aspetti da approfondire, come la tossicità (anche se i rischi sono minimizzati dal controllo della concentrazione e dall’uso in sistemi chiusi), ma le premesse sono davvero entusiasmanti. Chissà quali altre sorprese ci riserverà la chimica nel prossimo futuro! Io, come sempre, sarò qui pronto a raccontarvele!
Fonte: Springer