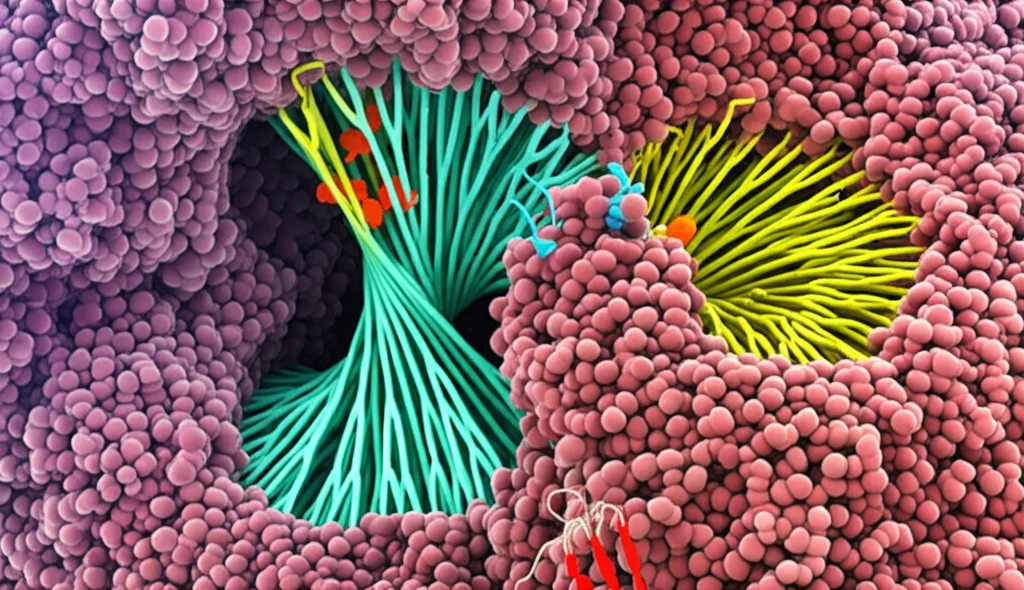
PAR1 e PAR2: Viaggio nel Cuore dell’Attivazione Molecolare
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico delle nostre cellule, per scoprire i segreti di una famiglia speciale di recettori chiamati PAR, o Recettori Attivati dalle Proteinasi (Proteinase-Activated Receptors). Immaginateli come delle minuscole antenne sulla superficie delle cellule, cruciali per un sacco di processi biologici: dalla coagulazione del sangue (emostasi) alla formazione di trombi, dallo sviluppo alla guarigione delle ferite, passando per l’infiammazione e persino la progressione dei tumori.
Una Famiglia di Recettori Unica nel Suo Genere
Questi recettori, PAR1, PAR2, PAR3 e PAR4, fanno parte della grande superfamiglia dei recettori accoppiati a proteine G (GPCR), ma hanno un modo tutto loro di “accendersi”. Invece di essere attivati da una molecola che arriva dall’esterno e si lega a loro (come la maggior parte dei GPCR), i PAR vengono “sbloccati” da un taglio netto! Enzimi specifici, chiamati proteasi, tagliano via un pezzetto della loro estremità esterna (il N-terminale). Questo taglio svela una nuova sequenza di amminoacidi, una sorta di “chiave” che era nascosta all’interno del recettore stesso. Questa chiave, chiamata “ligando ancorato” (tethered ligand), si ripiega e si lega al recettore, attivandolo dall’interno. È un meccanismo davvero ingegnoso!
Una volta attivati, i PAR scatenano una cascata di segnali all’interno della cellula, principalmente attraverso le proteine G e le beta-arrestine, mettendo in comunicazione il segnale esterno (la proteasi) con le funzioni cellulari. Capire esattamente come avviene questo “aggancio” del ligando ancorato e come cambia la struttura del recettore è fondamentale, ma fino ad oggi avevamo solo pezzi del puzzle.
I Protagonisti: PAR1 e PAR2
Concentriamoci sui due membri più studiati: PAR1 e PAR2.
- PAR1: È il “veterano”, il primo scoperto. Gioca un ruolo chiave nell’emostasi e nella trombosi. Lo troviamo principalmente sulle piastrine, sulle cellule muscolari lisce e sulle cellule endoteliali (quelle che rivestono i vasi sanguigni). Il suo attivatore principale è la trombina, un enzima cruciale nella cascata della coagulazione. Questo lo rende un bersaglio super interessante per sviluppare nuovi farmaci antitrombotici che siano efficaci ma con meno rischi di sanguinamento rispetto ai farmaci tradizionali.
- PAR2: Lui invece è attivato soprattutto da tripsina e triptasi. È coinvolto in processi diversi, come l’infiammazione e la risposta immunitaria. Si pensa che abbia un ruolo in malattie come l’infiammazione cronica, disturbi polmonari e anche nel cancro. La sua capacità di rispondere a diverse proteasi lo rende complesso ma anche un bersaglio promettente per trattare malattie infiammatorie e autoimmuni.
La Svolta: Vedere per Credere con la Criomicroscopia Elettronica
Il grande problema è sempre stato “vedere” questi recettori in azione, nel momento esatto in cui il ligando ancorato si lega e li attiva. Le strutture precedenti ci avevano mostrato i recettori legati a farmaci che li bloccavano (antagonisti) o in stati inattivi, ma mancava la foto cruciale: il complesso attivato dal suo ligando naturale.
Ed è qui che entra in gioco il nostro lavoro! Utilizzando una tecnica potentissima chiamata criomicroscopia elettronica (crio-EM), siamo riusciti a “congelare” e fotografare PAR1 e PAR2 proprio nel momento in cui sono attivati dal loro ligando ancorato e legati alle loro proteine G partner (le Gαq, in questo caso). È come aver scattato delle istantanee molecolari ad altissima risoluzione!
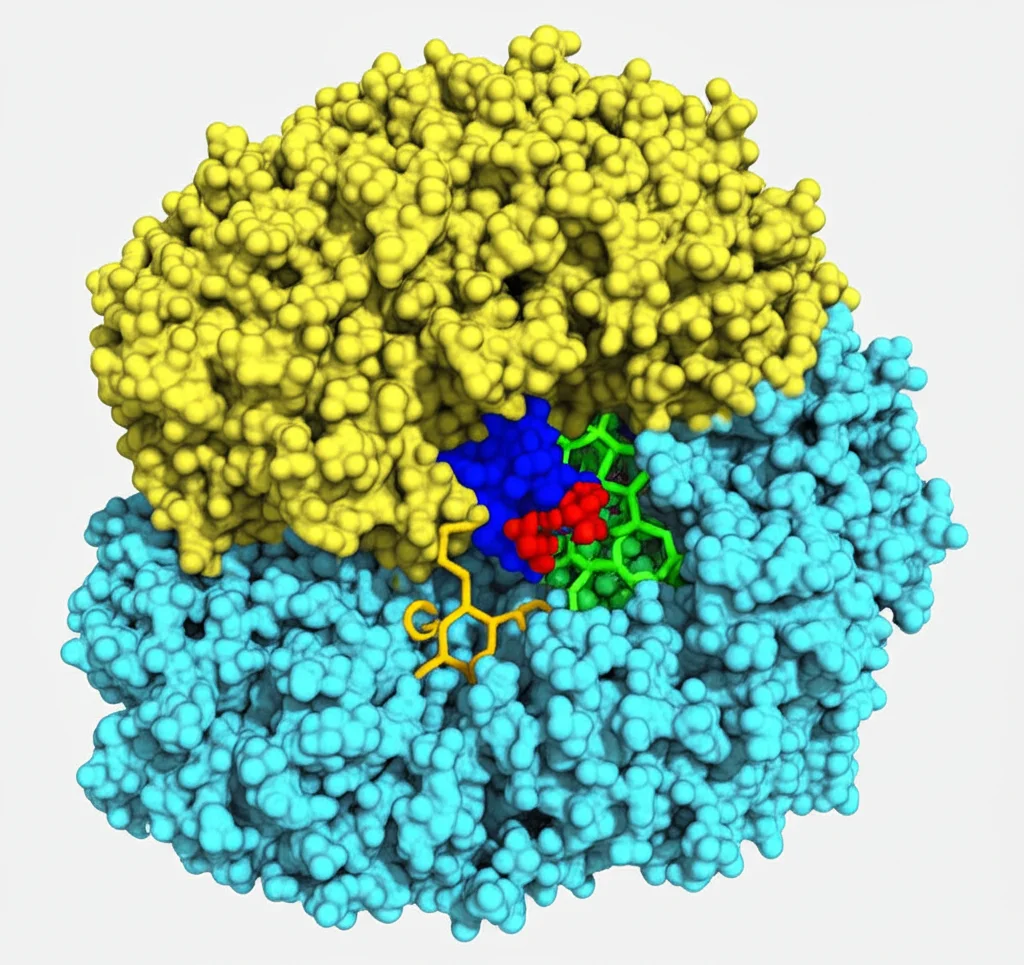
Cosa abbiamo scoperto? Beh, prima di tutto che la tasca dove si lega il ligando ancorato (il sito ortosterico) è sorprendentemente superficiale e stretta. Non è una caverna profonda come in altri GPCR. Per PAR1, attivato dalla trombina che svela la sequenza SFLLR, abbiamo visto i primi cinque amminoacidi (SFLLR) infilarsi in questa tasca, stabilendo contatti precisi con diverse parti del recettore. Per PAR2, attivato dalla tripsina che svela SLIG…, abbiamo visto i primi tre amminoacidi (SLI) fare qualcosa di molto simile.
Un Meccanismo di Attivazione Sorprendente
Confrontando le nostre strutture attivate con quelle precedenti legate agli antagonisti (come vorapaxar per PAR1 e AZ8838 per PAR2), abbiamo notato qualcosa di inaspettato. Molti GPCR, quando si attivano, mostrano un movimento molto ampio di una delle loro eliche transmembrana, la TM6. Pensate a una porta che si spalanca. Nei PAR1 e PAR2, invece, questo movimento della TM6 è minimo! C’è un piccolo spostamento verso l’esterno, ma niente di drammatico. La vera protagonista sembra essere un’altra elica, la TM7, che si muove di più.
Sembra che l’aggancio del ligando ancorato spinga verso il basso alcuni residui chiave, in particolare delle tirosine (un tipo di amminoacido), posizionate strategicamente sulle eliche TM7 e TM6. Questa spinta iniziale innesca una serie di piccoli riarrangiamenti a cascata che si propagano verso l’interno della cellula, cambiando la forma del recettore quel tanto che basta per permettergli di legare e attivare le proteine G. È un meccanismo più sottile, ma ugualmente efficace! E la cosa affascinante è che questo meccanismo sembra essere condiviso sia da PAR1 che da PAR2, suggerendo un modello di attivazione unificato per questa sottofamiglia.
Abbiamo identificato residui specifici, come Y3507.32 e Y3537.35 in PAR1 e le corrispondenti Y3237.32 e Y3267.35 in PAR2, come giocatori cruciali in questo “effetto domino” molecolare. Mutazioni in questi punti, infatti, compromettono l’attivazione del recettore.
Il Caso Curioso di GB88: Un Antagonista che Imita l’Agonista
Per rendere le cose ancora più interessanti, abbiamo studiato anche PAR2 legato a una piccola molecola chiamata GB88. Inizialmente descritta come un antagonista selettivo di PAR2, si è poi scoperto che GB88 ha un comportamento più complesso: blocca alcune vie di segnalazione (come quella legata a Gq che promuove l’infiammazione), ma ne attiva altre! È un cosiddetto “agonista parziale” o “agonista sbilanciato”.
La nostra struttura di PAR2 legato a GB88 e alla proteina Gq ci ha svelato il suo trucco: GB88 si infila proprio nella tasca ortosterica superficiale, andando a mimare molte delle interazioni chiave che il ligando ancorato naturale forma con il recettore! Si posiziona in modo incredibilmente simile al ligando SLI. Questo spiega come una piccola molecola possa “ingannare” il recettore e attivarlo, almeno parzialmente. Capire come GB88 riesca a fare questo gioco di prestigio molecolare è fondamentale per poter progettare in futuro farmaci ancora più specifici, capaci magari di bloccare solo le vie di segnalazione dannose associate a PAR2, lasciando intatte quelle benefiche.
Perché Tutto Questo è Importante?
Capire nel dettaglio come funzionano PAR1 e PAR2 a livello atomico non è solo una curiosità scientifica. Queste strutture ci forniscono una mappa precisa dei siti di legame e dei meccanismi di attivazione. Questa conoscenza è oro colato per chi progetta farmaci (il cosiddetto Structure-Based Drug Design, SBDD).
Ora sappiamo esattamente dove e come agisce il ligando naturale, come si differenzia il sito di legame da quello di alcuni antagonisti noti, e come una molecola come GB88 possa imitare l’attivatore endogeno. Questo apre la strada alla progettazione razionale di nuove molecole che possano:
- Bloccare PAR1 in modo più sicuro per prevenire la trombosi (come fa vorapaxar, anche se la sua modalità di legame è particolare).
- Modulare l’attività di PAR2 in modo selettivo per combattere l’infiammazione o altre malattie, magari sviluppando composti simili a GB88 ma con profili di attività ancora più mirati.
Insomma, queste “istantanee molecolari” non solo risolvono un mistero biologico fondamentale sull’attivazione dei PAR, ma ci danno anche gli strumenti per provare a intervenire terapeuticamente in modo più intelligente ed efficace. È la bellezza della biologia strutturale: vedere per capire, capire per agire!
Fonte: Springer