ATLAS: La Nuova Bussola per Navigare i Circuiti Segreti del Cervello
Introduzione: Un Viaggio nel Labirinto Neurale
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi affascina da morire: il nostro cervello. Pensateci un attimo: una rete incredibilmente complessa di miliardi di neuroni che comunicano tra loro per creare pensieri, emozioni, ricordi, movimenti… tutto! Capire come funzionano questi circuiti è una delle sfide più grandi e avvincenti delle neuroscienze. Per decenni, noi scienziati abbiamo cercato strumenti sempre più precisi per “mappare” queste connessioni, per capire chi parla con chi in questo labirinto intricato.
Tradizionalmente, avevamo metodi un po’ “grezzi” o strumenti virali potenti ma con qualche limitazione. Ad esempio, il famoso virus della rabbia modificato è fantastico per tracciare le connessioni *all’indietro* (retrogrado), cioè per scoprire chi manda segnali a un certo neurone di partenza. Ma cosa succede se vogliamo seguire il flusso dell’informazione nella sua direzione naturale, *in avanti* (anterogrado), dal neurone di partenza ai suoi bersagli? E se volessimo farlo partendo da tipi specifici di neuroni, scelti da noi geneticamente? Fino a poco tempo fa, mancava uno strumento che facesse proprio questo in modo pulito, specifico e affidabile. Ma ora, tenetevi forte, perché abbiamo sviluppato qualcosa di veramente speciale: ATLAS. E no, non parlo del titano che regge il mondo, ma di un acronimo che sta per “Anterograde Transsynaptic Label based on Antibody-like Sensors”. È un tracciante progettato razionalmente, pezzo per pezzo, per fare esattamente quello che ci serviva.
Cos’è ATLAS e Come Fa il Suo Lavoro?
Immaginate ATLAS come un messaggero super intelligente che possiamo programmare per una missione specifica. Lo “costruiamo” come una proteina speciale e lo facciamo esprimere solo nei neuroni che ci interessano (i nostri “neuroni di partenza”), magari usando tecniche genetiche come il sistema Cre-Lox, che ci permette di essere super selettivi.
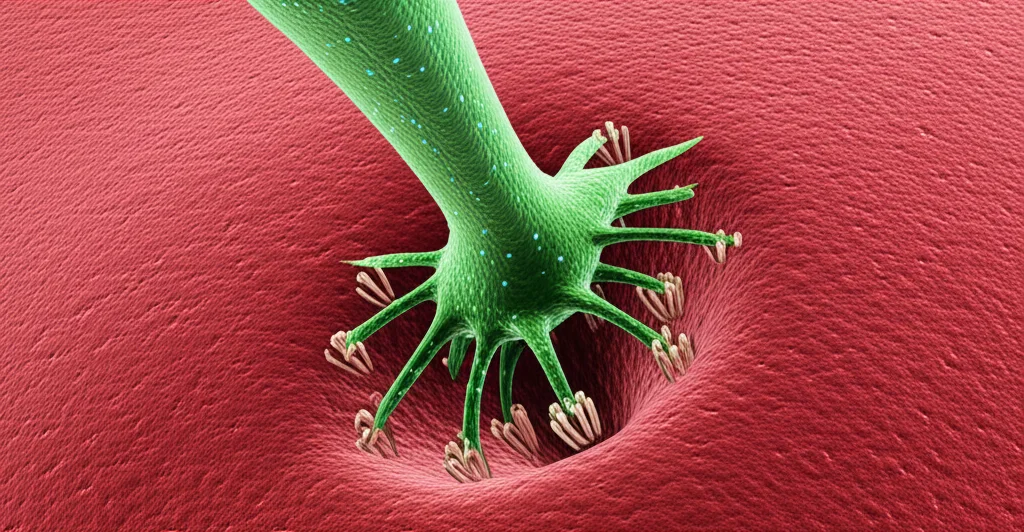
Una volta prodotto dentro il neurone di partenza, ATLAS viene indirizzato verso le “stazioni di spedizione” del segnale: le vescicole sinaptiche. Qui succede la magia: ATLAS è composto da diverse parti unite insieme. Una parte fondamentale è una specie di “chiave” molecolare (chiamata AMPA.FingR o AF), simile a un anticorpo, che abbiamo progettato per riconoscere e legarsi specificamente a una “serratura” presente sulla superficie dei neuroni *riceventi* (postsinaptici): il recettore GluA1, cruciale per la comunicazione eccitatoria. Accanto a questa chiave, c’è il “carico utile”: di solito una proteina chiamata ricombinasi (come Cre o FLP), che agisce come un interruttore genetico.
Quando il neurone di partenza si attiva e rilascia il suo segnale nella sinapsi (lo spazio tra due neuroni), rilascia anche il nostro ATLAS. La parte “chiave” (AF) si lega al recettore GluA1 sul neurone successivo. Questo legame fa sì che il neurone ricevente “inghiotta” l’intero pacchetto ATLAS tramite un processo chiamato endocitosi. Una volta dentro, il carico utile (la ricombinasi) viene trasportato fino al nucleo della cellula ricevente.
E qui arriva il bello: se nel neurone ricevente abbiamo precedentemente inserito un “gene reporter” dormiente (ad esempio, uno che produce una proteina fluorescente come la GFP o la mCherry, ma che è bloccato da sequenze specifiche sensibili alla ricombinasi), la ricombinasi portata da ATLAS lo “sblocca”. Il risultato? Il neurone postsinaptico inizia a produrre la proteina fluorescente e si illumina! Così, possiamo vedere esattamente quali neuroni ricevono il segnale dai nostri neuroni di partenza. È come accendere delle luci lungo uno specifico percorso neurale.

Perché ATLAS è Così Rivoluzionario? Le Sue Caratteristiche Uniche
Ok, direte voi, ma cosa rende ATLAS così speciale rispetto ad altri metodi? Beh, le sue caratteristiche sono davvero notevoli:
- Strettamente Anterogrado: ATLAS viaggia solo in avanti. A differenza di alcuni virus usati per il tracciamento, non c’è rischio che torni indietro, confondendo la mappa. Sappiamo esattamente da dove parte e dove arriva il segnale.
- Esclusivamente Transsinaptico: Il trasferimento avviene attraverso la sinapsi, grazie al legame specifico AF-GluA1. Non è un passaggio casuale tra cellule vicine. Lo abbiamo dimostrato! Abbiamo provato a far esprimere ATLAS in neuroni inibitori (che non usano GluA1 nelle loro sinapsi in uscita in questo modo) e… nessun passaggio ai neuroni successivi! Questo ci dà la certezza che stiamo mappando connessioni sinaptiche reali.
- Geneticamente Mirato: Possiamo decidere noi da quale tipo specifico di neurone far partire il tracciamento, usando linee di topi transgenici (come le linee Cre) o altri metodi genetici. Questo è fondamentale per studiare circuiti legati a funzioni o popolazioni cellulari ben definite.
- Monosinaptico: ATLAS fa un solo “salto”, dal neurone di partenza al suo diretto bersaglio postsinaptico. Non continua a saltare da un neurone all’altro come fanno alcuni virus, il che permette una mappatura precisa delle connessioni dirette, senza creare confusione con circuiti più lunghi. Abbiamo testato questo su percorsi noti a più sinapsi e ATLAS si è fermato dopo il primo salto, proprio come volevamo.
- Dipendente dall’Attività: Questa è una chicca! Sembra che più una sinapsi è attiva, più ATLAS viene trasferito. Lo abbiamo visto attivando artificialmente i neuroni di partenza (con tecniche come le DREADD): i neuroni postsinaptici si illuminavano di più! Questo suggerisce che ATLAS potrebbe non solo mappare le connessioni strutturali, ma anche evidenziare i circuiti più *attivi* durante un certo comportamento o stimolo. Immaginate le possibilità!
- Non Tossico (Specialmente la Versione Ottimizzata): I primi prototipi basati sulla proteina VAMP2 mostravano qualche segno di stress cellulare a lungo termine. Ma siamo riusciti a ottimizzare ATLAS sostituendo una parte di VAMP2 con un nanobody (un piccolo anticorpo) contro la sinaptotagmina (SYTnb), creando ATLASsn. Questa versione è molto più “gentile” con i neuroni, permettendo studi più lunghi senza danneggiare le cellule. Inoltre, non sembra interferire significativamente con la normale trasmissione sinaptica, come confermato da esperimenti di elettrofisiologia.
- Modulare e Versatile: ATLAS è costruito a moduli. Possiamo cambiare la “chiave” (AF) per farla legare ad altri recettori (magari per mappare circuiti inibitori o neuromodulatori), cambiare il “carico utile” (la ricombinasi) con altri strumenti molecolari, o migliorare ulteriormente il sistema di trasporto. È una piattaforma flessibile con un enorme potenziale di sviluppo.
ATLAS in Azione e Orizzonti Futuri
Abbiamo già testato ATLAS (e ATLASsn) con successo in diverse aree del cervello di topi e persino di ratti, mappando circuiti noti come quello dalla corteccia prefrontale allo striato, dalla corteccia visiva al collicolo superiore, dall’ippocampo al nucleo accumbens e molti altri. I risultati sono coerenti con l’anatomia conosciuta, ma ATLAS ci permette di farlo con una specificità genetica senza precedenti per il tracciamento anterogrado.
Certo, c’è ancora lavoro da fare. L’efficienza del tracciamento, anche se buona (specialmente se aiutiamo ATLAS co-esprimendo l’enzima BACE che lo “taglia” nel punto giusto per il rilascio), non è ancora del 100%. Inoltre, richiede l’iniezione di un virus reporter nell’area postsinaptica (anche se si potrebbero usare topi reporter transgenici). Ma i vantaggi superano di gran lunga questi aspetti.
La capacità di mappare circuiti specifici in modo anterogrado, monosinaaptico e potenzialmente dipendente dall’attività apre porte incredibili. Possiamo finalmente iniziare a svelare con precisione come specifici tipi di neuroni contribuiscono a comportamenti complessi, all’apprendimento, alla memoria o come i loro circuiti sono alterati in malattie neurologiche e psichiatriche. La modularità di ATLAS ci fa sognare: potremmo creare versioni per tracciare circuiti basati su neurotrasmettitori diversi, o magari versioni che si attivano solo durante specifici eventi, come la formazione di un ricordo.
Insomma, ATLAS non è solo un nuovo strumento, è una nuova filosofia per esplorare il cervello, basata su un design razionale e mirato. È come avere una bussola molto più precisa per navigare l’incredibile complessità dei nostri circuiti neurali. E io non vedo l’ora di vedere dove ci porterà questo viaggio!
Fonte: Springer Nature