Il Linguaggio Segreto delle Cellule Morenti: Svelato l’Atlante della Ferroptosi
Ciao a tutti! Oggi voglio parlarvi di un argomento che mi affascina da morire (letteralmente!): la morte cellulare programmata. No, non storcete il naso, non è così macabro come sembra. Anzi, è un processo fondamentale per la nostra salute. Esistono diversi modi in cui una cellula può “decidere” di uscire di scena, e uno dei più intriganti, scoperto relativamente di recente, si chiama ferroptosi.
Ma cosa succede *esattamente* quando una cellula va in ferroptosi? Cosa lascia dietro di sé? È un po’ come chiedersi cosa c’è nel testamento di qualcuno, ma a livello molecolare! Le cellule morenti, infatti, non spariscono nel nulla: rilasciano un cocktail di molecole, chiamato secretoma, che può mandare messaggi importanti al resto del corpo, in particolare al sistema immunitario.
Fino a poco tempo fa, però, non avevamo un quadro completo di cosa contenesse il secretoma specifico della ferroptosi. Ed è qui che entra in gioco la ricerca di cui vi parlo oggi, una sorta di “atlante” che mappa queste molecole segrete. Preparatevi, perché stiamo per decifrare il linguaggio nascosto delle cellule ferroptotiche!
Cos’è la Ferroptosi, in parole povere?
Immaginate una cellula come una piccola città protetta da mura (la membrana cellulare). La ferroptosi è un tipo di morte cellulare “regolata” (cioè programmata, non accidentale) che dipende dal ferro e da un processo chiamato perossidazione lipidica. In pratica, i grassi (lipidi) che compongono le mura della città iniziano a “irrancidire” in modo massiccio a causa di reazioni chimiche incontrollate che coinvolgono il ferro.
Normalmente, abbiamo dei guardiani che prevengono questo disastro. Uno dei più importanti è un enzima chiamato GPX4 (Glutatione Perossidasi 4), che ripara i danni ai lipidi. Esiste anche un altro sistema di difesa, guidato da una proteina chiamata FSP1, che agisce come una seconda linea di protezione, soprattutto in alcuni tipi di cancro.
Quando queste difese cedono, la perossidazione lipidica dilaga, creando prima piccoli buchi nelle mura e poi causandone il crollo completo (rottura della membrana plasmatica). È a questo punto che il contenuto della “città” si riversa all’esterno.
L’Indagine sul Secretoma: Un Approccio Multi-Omico
Per capire cosa viene rilasciato durante la ferroptosi, i ricercatori hanno usato un approccio “multi-omico”. Sembra complicato, ma significa semplicemente che hanno analizzato diversi tipi di molecole contemporaneamente:
- Proteomica: per identificare le proteine rilasciate.
- Lipidomica: per identificare i grassi e i loro derivati (come gli ossilipini).
- Metabolomica: per identificare piccole molecole (metaboliti) derivanti dal metabolismo cellulare.
Hanno indotto la ferroptosi in cellule in laboratorio (specificamente, fibroblasti embrionali di topo modificati per poter “spegnere” il gene GPX4) e poi hanno raccolto e analizzato il liquido circostante (il “supernatante”) dove si accumulano le molecole rilasciate. L’obiettivo? Creare il primo atlante completo del secretoma ferroptotico.

Le Proteine Rilasciate: DAMPs e Chaperoni, ma Niente Chemochine Tipiche
Cosa hanno trovato nell’atlante proteico? Un bel po’ di roba interessante! Le cellule ferroptotiche rilasciano diverse proteine che funzionano come segnali di pericolo per il sistema immunitario, i cosiddetti DAMPs (Damage-Associated Molecular Patterns). Tra queste spiccano:
- MIF (Macrophage Migration Inhibitory Factor): un mediatore chiave dell’immunità innata, che era già presente e “pronto all’uso” dentro la cellula.
- Proteine da shock termico (HSPs) e chaperoni: molecole che normalmente aiutano altre proteine a funzionare correttamente, ma che fuori dalla cellula possono suonare un campanello d’allarme. Il loro rilascio potrebbe indicare uno stress a livello del reticolo endoplasmatico, uno dei siti dove avviene la perossidazione lipidica.
Una scoperta sorprendente, però, è stata l’assenza di alcune molecole tipicamente rilasciate durante altri tipi di morte cellulare programmata, come la necroptosi. Mi riferisco a specifiche chemochine (come CXCL1 e CXCL2), che sono potenti richiami per le cellule immunitarie. Sembra quindi che la ferroptosi, pur essendo “rumorosa” a livello molecolare, usi un “vocabolario” proteico leggermente diverso dalla necroptosi per comunicare il pericolo.
Grassi “Arrabbiati”: Oxilipini e Prostaglandine
Passiamo alla lipidomica. Qui la star è la famiglia degli ossilipini, molecole derivate dall’ossidazione dei grassi, con note funzioni immunomodulatorie. Un marcatore distintivo della ferroptosi è l’aumento dell’espressione del gene Ptgs2 (noto anche come COX2), che produce un enzima fondamentale per la sintesi delle prostaglandine.
E infatti, l’analisi ha confermato che le cellule ferroptotiche rilasciano quantità significative di prostaglandine, in particolare la PGE2. Questo rilascio dipende proprio dalla perossidazione lipidica (infatti, bloccandola con un inibitore della ferroptosi come Ferrostatin-1, il rilascio diminuisce).
Oltre alle prostaglandine, sono stati trovati altri ossilipini derivati dall’acido arachidonico (come 15-HETE) e dall’acido linoleico (come 13-HODE e 12,13-DiHOME), suggerendo l’attivazione di diversi percorsi enzimatici legati al metabolismo dei lipidi durante la ferroptosi.

Il Rilascio Metabolico: ATP Precoce e un Profilo Unico
E le piccole molecole? La metabolomica ha rivelato sorprese notevoli! Una delle prime cose che accadono durante la ferroptosi, addirittura *prima* che la cellula mostri segni evidenti di morte o accumulo massiccio di lipidi perossidati, è un rilascio massiccio di ATP (la “moneta energetica” della cellula). Questo rilascio precoce e intenso sembra essere una caratteristica distintiva della ferroptosi rispetto, ad esempio, alla necroptosi indotta da TNF.
Ma non è tutto. Man mano che la ferroptosi progredisce, le cellule rilasciano un profilo unico di metaboliti, tra cui:
- Intermedi del ciclo di Krebs (TCA).
- Metaboliti del ciclo della metionina (importante per molte funzioni cellulari, inclusa la sintesi di molecole antiossidanti come il glutatione, che viene consumato durante la ferroptosi).
- Derivati delle purine e pirimidine (i mattoni del DNA e RNA), incluso l’acido urico e il nucleotide ossidato 8-OHdG, un noto marcatore di danno ossidativo.
- Lattato, suggerendo un possibile aumento della glicolisi.
È interessante notare che, nelle fasi iniziali, *dentro* le cellule che stanno per andare in ferroptosi, si osserva un accumulo di intermedi della via dei pentoso fosfati (PPP) e un aumento della sintesi di nucleotidi. Questo suggerisce che la cellula, forse nel tentativo di difendersi dallo stress ossidativo, attiva percorsi metabolici anabolici prima di soccombere. La ferroptosi si conferma sempre più come una forma di morte cellulare profondamente legata al metabolismo.
La Connessione Immunitaria: Il “Priming” dei Macrofagi
Ok, abbiamo questo ricco “atlante” di molecole rilasciate. Ma che effetto fa tutto ciò sul sistema immunitario? Per scoprirlo, i ricercatori hanno preso i supernatanti delle cellule ferroptotiche e li hanno messi a contatto con i macrofagi, le cellule “spazzine” e sentinelle del nostro sistema immunitario.
Il risultato è stato affascinante. I secretomi ferroptotici non sembravano attivare completamente i macrofagi da soli (non inducevano un rilascio massiccio di citochine infiammatorie). Tuttavia, facevano qualcosa di più subdolo: li “preparavano”, li rendevano più reattivi a un successivo stimolo infiammatorio. Questo fenomeno si chiama priming.
In pratica, i macrofagi esposti al secretoma ferroptotico, se poi stimolati con LPS (una molecola batterica che mima un’infezione), producevano molte più citochine infiammatorie (come TNF e IL-6) rispetto ai macrofagi non “preparati”. Era come se il secretoma ferroptotico avesse messo i macrofagi in uno stato di “allerta”, pronti a scattare al minimo segnale successivo.
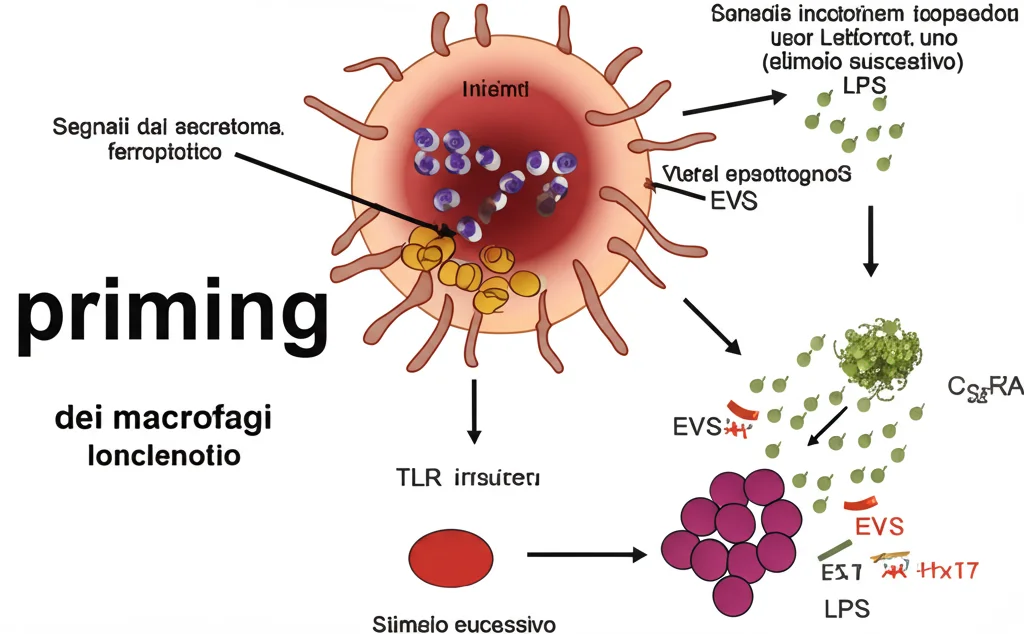
Ulteriori esperimenti hanno mostrato che questo effetto di priming dipende dai recettori Toll-like (TLR) sulla superficie dei macrofagi (in particolare TLR2, TLR4, TLR9) e dalle molecole adattatrici a valle (MyD88 e TRIF). Inoltre, sembra che una parte importante di questa attività di priming sia mediata dalle vescicole extracellulari (EVs), piccole “bolle” rilasciate dalle cellule ferroptotiche che possono trasportare un carico complesso di proteine, lipidi (magari ossidati?) e metaboliti. È interessante notare che i supernatanti di cellule necroptotiche (indotte da ZBP1, senza TNF) non mostravano questa capacità di priming. Un’altra differenza chiave!
Ricapitolando: La Timeline della Ferroptosi e il Suo Secretoma
Possiamo quindi tracciare una sorta di cronologia degli eventi:
- Fase Precoce: Rilascio massiccio di ATP, attivazione intracellulare della via dei pentoso fosfati e sintesi di nucleotidi.
- Fase Intermedia: Inizio dell’accumulo di perossidi lipidici, rilascio della proteina MIF e di metaboliti del ciclo di Krebs e della metionina.
- Fase Tardiva: Rottura completa della membrana, rilascio di enzimi citoplasmatici come LDH e di prostaglandine (PGE2).
Durante tutto il processo, vengono rilasciate anche EVs che contribuiscono all’effetto di priming sui macrofagi.
![]()
Perché Tutto Questo è Importante?
Capire cosa rilasciano le cellule ferroptotiche e come questo influenzi l’immunità è cruciale. La ferroptosi è implicata in tantissime condizioni, sia fisiologiche che patologiche:
- Cancro: Può avere effetti sia pro- che anti-tumorali, a seconda del contesto. Indurre la ferroptosi nelle cellule tumorali è una strategia terapeutica promettente, ma bisogna capire come il suo secretoma influenzi la risposta immunitaria anti-cancro.
- Malattie neurodegenerative: Ci sono prove del coinvolgimento della ferroptosi in malattie come Alzheimer e Parkinson.
- Danno da ischemia-riperfusione: Tipico dell’infarto o dell’ictus, dove la ferroptosi contribuisce al danno tissutale.
- Infiammazione cronica e malattie autoimmuni.
L’atlante del secretoma ferroptotico ci fornisce una mappa dettagliata per esplorare questi contesti. Il fatto che la ferroptosi induca un “priming” immunitario piuttosto che un’attivazione diretta apre scenari complessi: potrebbe questo priming esacerbare l’infiammazione in alcune malattie? O potrebbe essere sfruttato per potenziare la risposta immunitaria in altri contesti, come contro i tumori?
Insomma, questo studio non è solo un catalogo di molecole, ma apre la porta a una comprensione più profonda di come la morte cellulare per ferroptosi dialoghi con il nostro corpo e modelli le risposte infiammatorie e immunitarie. C’è ancora tanto da scoprire, ma ora abbiamo una mappa molto più dettagliata per orientarci in questo affascinante territorio della biologia cellulare. Alla prossima!
Fonte: Springer