Astrociti Ribelli: Come Infiammazione e Ipossia Alimentano le Malformazioni Artero-Venose Cerebrali (MAV)
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante e complesso che accade nel nostro cervello: le malformazioni artero-venose cerebrali, o MAV. Immaginate un groviglio disordinato di vasi sanguigni nel cervello, dove arterie e vene si collegano direttamente senza i capillari a fare da intermediari. Questo crea un flusso sanguigno anomalo, ad alta pressione, che rende questi vasi fragili e inclini alla rottura. Purtroppo, le MAV sono una delle cause principali di ictus emorragico, specialmente nei giovani.
Il Problema delle MAV: Non Solo Vasi Sanguigni “Sbagliati”
Per molto tempo, abbiamo pensato che il problema principale delle MAV fosse una disfunzione delle cellule endoteliali, quelle che rivestono l’interno dei vasi sanguigni. Certo, sono fondamentali, ma forse ci stavamo perdendo qualcosa. E se l’ambiente circostante, il cosiddetto microambiente cerebrale, e altre cellule nervose giocassero un ruolo chiave? Qui entrano in gioco gli astrociti. Queste cellule, le più abbondanti nel nostro sistema nervoso centrale, sono come i factotum del cervello: aiutano a regolare il flusso sanguigno, mantengono l’integrità della barriera emato-encefalica (una specie di filtro super selettivo tra sangue e cervello) e assicurano che tutto funzioni a dovere. Ma cosa succede quando si trovano nel bel mezzo del caos di una MAV? Il loro comportamento cambia? E come influisce sulla malattia? Queste sono le domande che ci siamo posti.
Un Microambiente Ostile: Infiammazione e Mancanza d’Ossigeno
Studiando le MAV, ci siamo resi conto che il loro microambiente è tutt’altro che tranquillo. È caratterizzato da due fattori principali: neuroinfiammazione e ipossia (carenza di ossigeno). Questi due elementi sembrano essere strettamente legati alla progressione della malattia e all’aumento del rischio di emorragia. Pensate a un’area del cervello costantemente infiammata e con poco ossigeno a disposizione: non proprio l’ideale per la stabilità dei vasi sanguigni, vero? Il problema è che non capivamo ancora bene come le cellule rispondessero a questo ambiente ostile.
Gli Astrociti Cambiano Faccia (e Funzione)
Ed ecco che torniamo ai nostri astrociti. In condizioni normali, sono cellule tranquille, con tante ramificazioni che avvolgono i vasi sanguigni come una coperta protettiva. Ma nel microambiente infiammato e ipossico delle MAV, le cose cambiano drasticamente. Abbiamo osservato che gli astrociti vicino alle lesioni MAV subiscono una trasformazione fenotipica: perdono le loro ramificazioni, assumono una forma più allungata, quasi “a fascio”, e si “ritirano” dai vasi sanguigni. Questa perdita di contatto è un grosso problema, perché significa meno supporto alla barriera emato-encefalica e una maggiore instabilità vascolare.
Ma non è tutto. Abbiamo scoperto un meccanismo molecolare affascinante. Le cellule endoteliali delle MAV producono ossido nitrico (NO). Questo NO, a sua volta, agisce sugli astrociti vicini stabilizzando una proteina chiamata HIF-1α (Hypoxia-Inducible Factor 1-alpha). HIF-1α è una sorta di “interruttore molecolare” che normalmente si attiva quando manca ossigeno, per aiutare le cellule ad adattarsi. La cosa sorprendente è che, nel contesto delle MAV, questo interruttore viene attivato negli astrociti anche in condizioni di ossigeno normale, grazie all’NO proveniente dalle cellule endoteliali! È come se gli astrociti fossero indotti a credere di essere in ipossia costante.

L’attivazione di HIF-1α scatena un programma genetico “ipossico” negli astrociti. Questi iniziano a produrre una serie di molecole, tra cui fattori che promuovono l’angiogenesi (formazione di nuovi vasi, spesso disfunzionali in questo contesto), la rimodellazione della matrice extracellulare e, soprattutto, molecole infiammatorie.
Il Ruolo Chiave della COX-2: Un Bersaglio Terapeutico?
Tra i geni attivati da HIF-1α negli astrociti “ingannati”, uno in particolare ha attirato la nostra attenzione: la Cicloossigenasi-2 (COX-2). La COX-2 è un enzima ben noto per il suo ruolo nell’infiammazione. Produce prostaglandine, molecole che alimentano la risposta infiammatoria e possono contribuire al rimodellamento vascolare e all’instabilità. Abbiamo visto che i livelli di COX-2 sono significativamente aumentati sia nel tessuto cerebrale delle MAV che specificamente negli astrociti reattivi di queste lesioni.
Questa scoperta ci ha fatto pensare: e se bloccassimo la COX-2? Potremmo ridurre l’infiammazione e magari stabilizzare i vasi fragili delle MAV? La COX-2 è già il bersaglio di farmaci anti-infiammatori comuni, come il Celecoxib.
Mettere alla Prova l’Ipotesi: Esperimenti e Risultati Promettenti
Per verificare la nostra idea, abbiamo utilizzato un modello animale di MAV che riproduce fedelmente le caratteristiche della malattia umana, inclusa la tendenza all’emorragia. Abbiamo trattato questi animali con Celecoxib, l’inibitore della COX-2. I risultati sono stati davvero incoraggianti!
- Riduzione delle Emorragie: Gli animali trattati con Celecoxib hanno mostrato un numero significativamente inferiore di emorragie cerebrali rispetto a quelli non trattati.
- Miglioramento Neurologico: L’emorragia cerebrale causa danni neuronali e deficit neurologici. Abbiamo osservato che il trattamento con Celecoxib riduceva la morte neuronale attorno alle lesioni e migliorava le funzioni motorie, l’equilibrio e persino le capacità di apprendimento e memoria degli animali, valutate con specifici test comportamentali.
- Stabilizzazione Vascolare: Il Celecoxib sembrava “riparare” i danni ai vasi. Abbiamo notato una minore perdita di liquido dai vasi (indice di una migliore integrità della barriera) e un recupero dei livelli delle proteine delle giunzioni strette (come Claudina-5 e Occludina), che sono come il “cemento” che tiene unite le cellule endoteliali.
- Effetto sugli Astrociti: Sorprendentemente, il trattamento ha anche parzialmente “normalizzato” l’aspetto e la funzione degli astrociti. I livelli di HIF-1α si sono ridotti e gli astrociti hanno riacquistato una morfologia più simile a quella normale, con una maggiore copertura dei vasi sanguigni.
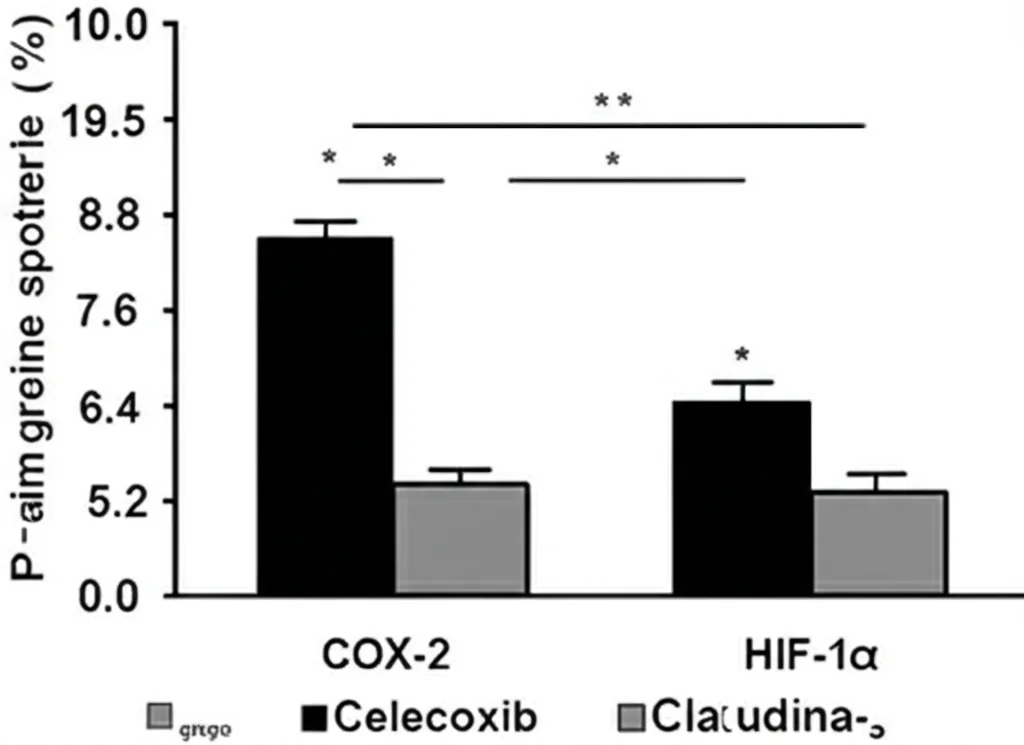
Questi risultati suggeriscono fortemente che l’infiammazione (mediata in parte dalla COX-2) e l’attivazione “anomala” della via dell’ipossia (HIF-1α) negli astrociti creano un circolo vizioso. L’ambiente MAV stressa gli astrociti, che cambiano e diventano pro-infiammatori, destabilizzando ulteriormente i vasi, aumentando il rischio di rottura, peggiorando l’ipossia e l’infiammazione locali… e così via. Il Celecoxib sembra interrompere questo ciclo agendo sulla COX-2, riducendo l’infiammazione e, di conseguenza, migliorando la stabilità vascolare e la funzione degli astrociti.
Cosa Abbiamo Imparato e Prospettive Future
Questa ricerca ci ha aperto gli occhi sul ruolo cruciale degli astrociti e del microambiente infiammatorio e ipossico nella progressione delle MAV e nel rischio di emorragia. Non si tratta solo di un problema “endoteliale”, ma di un’interazione complessa tra diverse cellule e segnali molecolari all’interno del cervello.
Abbiamo identificato la via HIF-1α/COX-2 negli astrociti come un meccanismo chiave che contribuisce alla disfunzione neurovascolare nelle MAV. Questo suggerisce che la COX-2 potrebbe essere un bersaglio terapeutico promettente. L’uso di inibitori della COX-2, farmaci già esistenti e relativamente sicuri, potrebbe rappresentare una nuova strategia farmacologica per stabilizzare i vasi delle MAV e ridurre il rischio di emorragie devastanti, magari in combinazione con i trattamenti attuali (chirurgia, embolizzazione, radiochirurgia) o come opzione per i casi non trattabili.
Certo, siamo ancora all’inizio. Questi risultati provengono da modelli animali e serviranno ulteriori ricerche per confermare l’efficacia e la sicurezza di questo approccio nell’uomo, definendo dosaggi e tempi di trattamento ottimali. Inoltre, dobbiamo capire ancora più a fondo come esattamente gli astrociti “modificati” comunicano con le cellule endoteliali per causare instabilità.
Ma la strada è tracciata: guardare oltre le cellule endoteliali e considerare l’intero microambiente, con gli astrociti come protagonisti inaspettati, potrebbe rivoluzionare il modo in cui comprendiamo e trattiamo le MAV cerebrali. È un campo di ricerca entusiasmante che promette nuove speranze per i pazienti affetti da questa complessa patologia.

Fonte: Springer