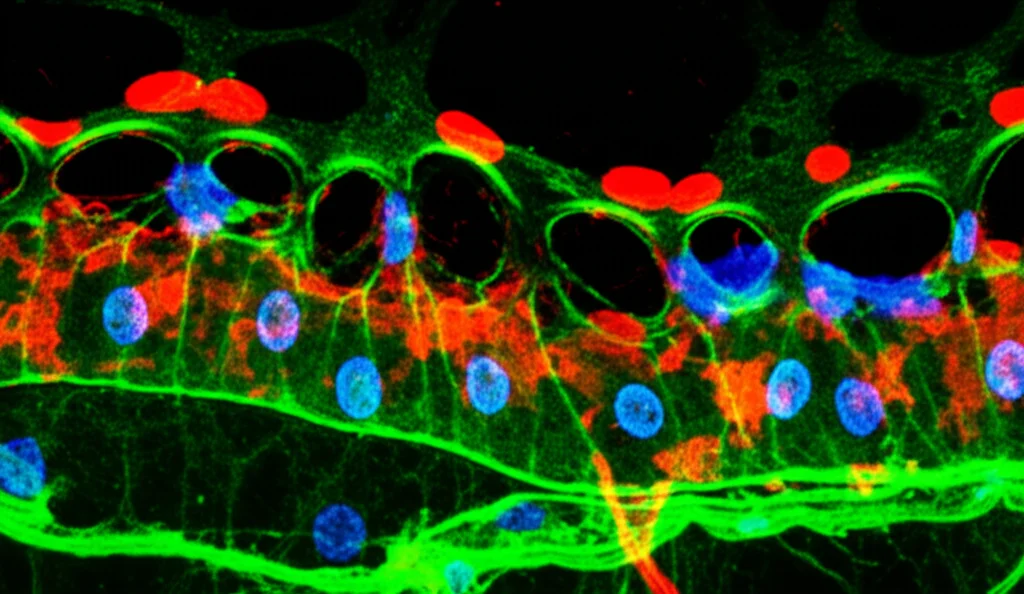
Astrociti Hes5+: I Registi Silenziosi che Amplificano il Dolore nel Midollo Spinale
Ciao a tutti! Oggi vi porto in un viaggio affascinante nel cuore del nostro sistema nervoso, precisamente nel midollo spinale. Parleremo di cellule che per molto tempo sono state considerate semplici “aiutanti” dei neuroni, ma che si stanno rivelando dei veri e propri protagonisti: gli astrociti. E in particolare, ci concentreremo su una sottopopolazione molto speciale, gli astrociti che esprimono una proteina chiamata Hes5.
Il corno dorsale del midollo spinale (che chiameremo SDH, dall’inglese Spinal Dorsal Horn) è come una stazione di smistamento super importante per le informazioni sensoriali che arrivano dal nostro corpo, specialmente quelle legate al dolore. Qui, i segnali vengono processati prima di essere inviati al cervello. Immaginate un intricato circuito elettrico: gli astrociti sono lì, non solo per dare supporto strutturale, ma per regolare attivamente come questi segnali passano da un neurone all’altro, cioè la trasmissione sinaptica.
Una Scoperta Precedente e una Domanda Aperta
Nel mio lavoro precedente, insieme ai miei colleghi, avevamo fatto una scoperta intrigante: stimolando specificamente questi astrociti Hes5+ nell’SDH, si scatenava un’ipersensibilità al dolore negli animali da esperimento. Era chiaro che queste cellule avessero un ruolo nel “volume” del dolore, ma la domanda rimaneva: come facevano esattamente? Qual era il meccanismo a livello delle sinapsi, i punti di contatto tra neuroni?
Alla Ricerca del Meccanismo: L’Esperimento
Per capirlo, abbiamo deciso di “accendere” selettivamente questi astrociti Hes5+ e vedere cosa succedeva alla comunicazione tra le fibre nervose che portano il segnale del dolore (le fibre Aδ e C, che sono i primi messaggeri del dolore dalla periferia) e i neuroni della Lamina I dell’SDH, che sono tra i primi a ricevere questo messaggio.
Come abbiamo fatto? Abbiamo usato tecniche di chemogenetica. In pratica, abbiamo modificato geneticamente i topi in modo che solo i loro astrociti Hes5+ esprimessero un recettore artificiale (chiamato hM3Dq). Questo recettore può essere attivato da una sostanza specifica (la DCZ) che altrimenti non farebbe nulla. Dando la DCZ, potevamo “accendere” solo gli astrociti Hes5+ nell’SDH.
Poi, abbiamo preparato delle fettine sottili di midollo spinale mantenendo intatte le connessioni con le radici dorsali (dove entrano le fibre Aδ e C). Usando tecniche di elettrofisiologia (in particolare, il patch-clamp), ci siamo messi “in ascolto” dei neuroni della Lamina I mentre stimolavamo elettricamente le fibre Aδ e C. Misuravamo le correnti elettriche generate nei neuroni della Lamina I, chiamate Correnti Postsinaptiche Eccitatorie (EPSCs), che rappresentano il segnale ricevuto.
Cosa Abbiamo Trovato: Un Amplificatore per il Dolore
E qui arriva il bello! Quando abbiamo attivato gli astrociti Hes5+ con la DCZ, abbiamo osservato un aumento significativo dell’ampiezza delle EPSCs polisaptiche nei neuroni della Lamina I. Cosa significa “polisaptiche”? Vuol dire che il segnale non arriva direttamente dalla fibra Aδ/C al neurone registrato, ma passa attraverso uno o più neuroni intermedi. L’attivazione degli astrociti Hes5+ rendeva questa comunicazione a più tappe molto più forte!
Curiosamente, le EPSCs monosinaptiche (quelle dirette, senza intermediari) non sembravano cambiare molto. Questo ci ha dato un indizio importante sul meccanismo.
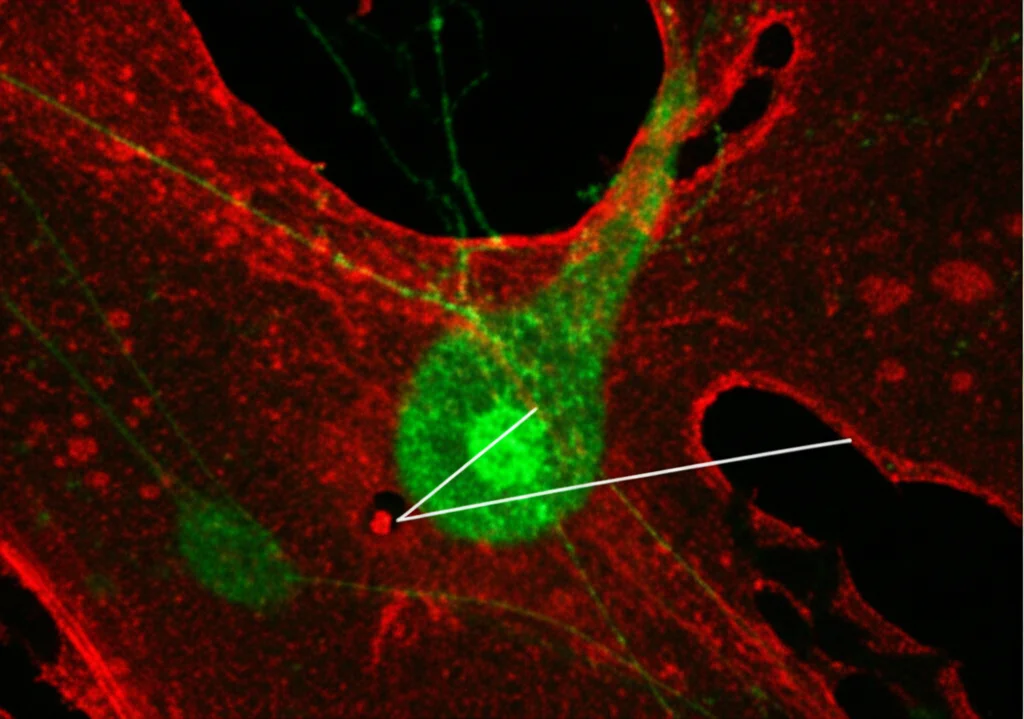
Per essere sicuri che non fosse una stranezza legata solo a quel modello di topo, abbiamo ripetuto l’esperimento usando un approccio leggermente diverso per attivare un gruppo più ampio di astrociti (inclusi gli Hes5+) in topi normali, ottenendo lo stesso risultato: l’attivazione degli astrociti potenziava le risposte polisaptiche.
Il Ruolo Chiave dei Recettori NMDA
Ma come fanno gli astrociti a potenziare questi segnali? Sappiamo che gli astrociti possono rilasciare diverse sostanze chimiche che influenzano i neuroni. Basandoci sui nostri studi precedenti, avevamo un sospettato principale: la D-serina. Questa molecola agisce su un tipo specifico di recettore sui neuroni, il recettore NMDA (N-metil-D-aspartato), legandosi a un sito particolare chiamato sito di legame per la glicina. I recettori NMDA sono cruciali per l’apprendimento, la memoria e… anche per la sensibilizzazione al dolore.
Per verificare questa ipotesi, abbiamo ripetuto gli esperimenti di attivazione degli astrociti Hes5+, ma questa volta abbiamo aggiunto dei farmaci che bloccano specificamente i recettori NMDA:
- DCK: blocca il sito di legame per la glicina (dove pensiamo agisca la D-serina rilasciata dagli astrociti).
- MK-801: blocca il canale del recettore NMDA stesso.
Risultato? Entrambi i farmaci hanno completamente impedito l’aumento delle EPSCs indotto dall’attivazione degli astrociti! Bingo! Questo suggerisce fortemente che gli astrociti Hes5+, quando attivati, potenziano la trasmissione del segnale doloroso agendo sui recettori NMDA, probabilmente attraverso il rilascio di D-serina (anche se, per onestà scientifica, non abbiamo misurato direttamente il rilascio di D-serina in questo studio, ma è l’ipotesi più probabile e supportata da altri dati).
E perché solo le risposte polisaptiche? Una possibile spiegazione tecnica è che, alle condizioni sperimentali usate (-70 mV), i recettori NMDA sono parzialmente bloccati da ioni magnesio nelle sinapsi dirette (monosinaptiche), che sono dominate da altri recettori (gli AMPA). Invece, nelle connessioni indirette (polisaptiche), i recettori NMDA potrebbero giocare un ruolo più rilevante e quindi essere più sensibili alla “spinta” data dagli astrociti. In pratica, gli astrociti Hes5+ sembrano “alzare il volume” preferenzialmente sui circuiti un po’ più complessi del dolore all’interno dell’SDH, agendo sui recettori NMDA presenti sui neuroni intermedi.
Non Solo Reazione: Astrociti Attivi Anche in Salute
Questo studio è importante perché mostra che gli astrociti, e in particolare questa sottopopolazione Hes5+, non sono solo coinvolti nelle risposte al danno o nelle condizioni di dolore cronico, dove si sa che diventano “reattivi” e rilasciano molecole infiammatorie. Qui vediamo che possono modulare attivamente la trasmissione del dolore anche in condizioni “normali”, fisiologiche, semplicemente essendo stimolati.
Pensateci: il nostro corpo ha sistemi endogeni che possono attivare questi astrociti. Ad esempio, abbiamo dimostrato in passato che la noradrenalina, rilasciata da vie nervose discendenti, può attivare gli astrociti Hes5+ tramite recettori specifici (α1A) e causare ipersensibilità al dolore, un effetto che viene bloccato dal DCK (il farmaco che blocca il sito della glicina sui recettori NMDA). Quindi, è possibile che questo meccanismo astrocita-NMDA sia usato dal nostro stesso sistema nervoso per regolare la sensibilità al dolore.
Inoltre, altre ricerche suggeriscono che l’attivazione degli astrociti nell’SDH potrebbe anche ridurre la trasmissione sinaptica inibitoria. Se mettiamo insieme i pezzi, l’attivazione degli astrociti Hes5+ potrebbe avere un doppio effetto:
- Aumentare l’eccitazione (come abbiamo visto qui).
- Diminuire l’inibizione.
Il risultato netto sarebbe un aumento generale dell’eccitabilità dei circuiti del dolore nell’SDH.
Conclusioni e Prospettive Future
In sintesi, abbiamo scoperto un meccanismo affascinante: gli astrociti Hes5+ nel corno dorsale del midollo spinale agiscono come potenziatori della trasmissione sinaptica eccitatoria proveniente dalle fibre del dolore (Aδ e C) verso i neuroni della Lamina I. Lo fanno potenziando l’attività dei recettori NMDA, probabilmente tramite il rilascio di D-serina.
Questa scoperta apre nuove prospettive sulla comprensione di come viene regolato il dolore a livello spinale e potrebbe, in futuro, suggerire nuovi bersagli terapeutici. C’è ancora molto da esplorare, ad esempio il ruolo di altre cellule come la microglia in questa interazione e misurare direttamente il rilascio di D-serina. Ma una cosa è certa: gli astrociti sono molto più che semplici spettatori nel complesso teatro del sistema nervoso!
Fonte: Springer