Argento e DNA: Ho Spiato il Loro Primo Incontro Segreto con la RMN!
Avete mai pensato a come i metalli “parlano” con il nostro DNA? È un mondo affascinante, pieno di segreti e interazioni complesse che possono avere effetti profondi, sia positivi che negativi. Io e il mio team ci siamo tuffati in questa avventura, armati di una potente lente d’ingrandimento molecolare, la spettroscopia di Risonanza Magnetica Nucleare (RMN), per spiare uno specifico incontro: quello tra gli ioni argento (Ag+) e il DNA nella sua forma più classica, la doppia elica B.
Ci siamo chiesti: quando l’argento incontra il DNA, dove va a “sedersi” per primo? Quali sono i suoi siti di legame preferiti? Capirlo è fondamentale, non solo per pura curiosità scientifica, ma anche perché queste interazioni sono alla base di potenziali applicazioni, dalla nanotecnologia alla medicina.
Perché l’Argento e Perché il DNA?
Il DNA, la molecola della vita, offre diversi “punti di aggancio” per gli ioni metallici. Immaginate il DNA come una scala a chiocciola:
- I “corrimano” (lo scheletro zucchero-fosfato) sono carichi negativamente e possono attrarre cationi per interazioni elettrostatiche, specialmente quelli “duri” come gli ioni alcalino-terrosi.
- I “gradini” (le basi azotate) contengono atomi di azoto che possono coordinare cationi più “morbidi”, come quelli dei metalli di transizione. Un sito particolarmente gettonato è l’azoto N7 delle purine (Adenina e Guanina), accessibile nella scanalatura maggiore dell’elica. Pensate al cisplatino, un farmaco antitumorale che lega proprio l’N7 delle purine!
- Infine, i metalli possono infilarsi proprio *tra* i gradini, formando quelle che chiamiamo “coppie di basi mediate da metallo”, dove lo ione metallico si posiziona tra due basi su filamenti opposti. L’argento è un maestro in questo, capace di mediare coppie come Citosina-Ag+-Citosina (C–Ag+–C) o Guanina-Ag+-Guanina (G–Ag+–G).
L’argento, in particolare, è noto per la sua versatilità nel formare queste coppie mediate da metallo con quasi tutte le basi canoniche (tranne l’Adenina, in forma solida). Questa sua “promiscuità” rende difficile prevedere esattamente come interagirà con una sequenza di DNA specifica. Addirittura, in presenza di abbastanza argento, il DNA può riorganizzarsi completamente, formando strutture simili a “nanofili” metallo-DNA.
Proprio per far luce su questo comportamento, abbiamo deciso di studiare i primissimi momenti dell’interazione. Dove si lega l’argento quando incontra per la prima volta un DNA “normale”, non modificato?
L’Esperimento: RMN e CD Sotto i Riflettori
Per rispondere a questa domanda, abbiamo scelto un “pezzo” di DNA ben noto e studiato, quasi una celebrità nel campo: il Dodecamero di Dickerson-Drew (DD12), una sequenza di 12 basi auto-complementare (d(CGCGAATTCGCG)) che forma una perfetta doppia elica B.
Cosa abbiamo fatto? Semplice (si fa per dire!): abbiamo preso il nostro DD12 in soluzione e abbiamo iniziato ad aggiungere ioni argento (AgNO3), un po’ alla volta, monitorando cosa succedeva. Abbiamo usato due tecniche principali:
- Spettroscopia RMN (1H e 31P): Questa tecnica è come una lente d’ingrandimento super potente che ci permette di “vedere” la posizione e l’intorno chimico di specifici atomi (in questo caso, protoni e fosforo) nella molecola di DNA. Se l’argento si lega vicino a un certo atomo, il segnale RMN di quell’atomo cambierà (si sposterà, si allargherà, o addirittura sparirà).
- Dicroismo Circolare (CD): Questa tecnica ci dà informazioni sulla struttura secondaria globale della molecola, cioè sulla forma generale della doppia elica. Grandi cambiamenti nello spettro CD indicano significative riorganizzazioni strutturali.
Abbiamo registrato spettri RMN e CD a diverse concentrazioni di argento, da zero fino a un eccesso di ioni.
Cosa Abbiamo Scoperto: L’Argento Preferisce l’Interno!
I risultati sono stati davvero illuminanti! Ecco cosa abbiamo osservato passo dopo passo:
1. Cambiamenti Strutturali Dipendenti dalla Concentrazione:
Gli spettri CD hanno mostrato che aggiungendo pochi ioni argento (fino a circa 3-4 ioni per doppia elica), la struttura generale del B-DNA cambiava pochissimo. Questo suggerisce che l’elica manteneva la sua forma classica. Tuttavia, superata questa soglia, i cambiamenti diventavano drastici! Lo spettro CD si trasformava completamente, assumendo una forma caratteristica già vista in studi precedenti, associata a DNA riorganizzati con molte coppie di basi mediate da argento. Con un eccesso di argento (oltre 12 ioni per duplex, cioè uno per coppia di basi), abbiamo persino osservato la formazione di aggregati e la precipitazione del DNA, probabilmente sotto forma di quei “nanofili” metallo-DNA.
2. Esclusione dello Scheletro Fosfato:
Abbiamo guardato gli spettri RMN del fosforo (31P). Se l’argento si fosse legato principalmente allo scheletro fosfato carico negativamente, ci saremmo aspettati cambiamenti significativi nei segnali del fosforo. Invece, con basse concentrazioni di argento, i segnali 31P erano influenzati solo marginalmente (principalmente un allargamento e una diminuzione di intensità generale, ma senza spostamenti specifici evidenti). Questo ci ha fatto pensare che lo scheletro fosfato non fosse il sito di legame iniziale preferito per l’argento, uno ione “morbido” che preferisce legarsi ad atomi donatori “morbidi” come l’azoto.
3. Esclusione dell’N7 nella Scanalatura Maggiore:
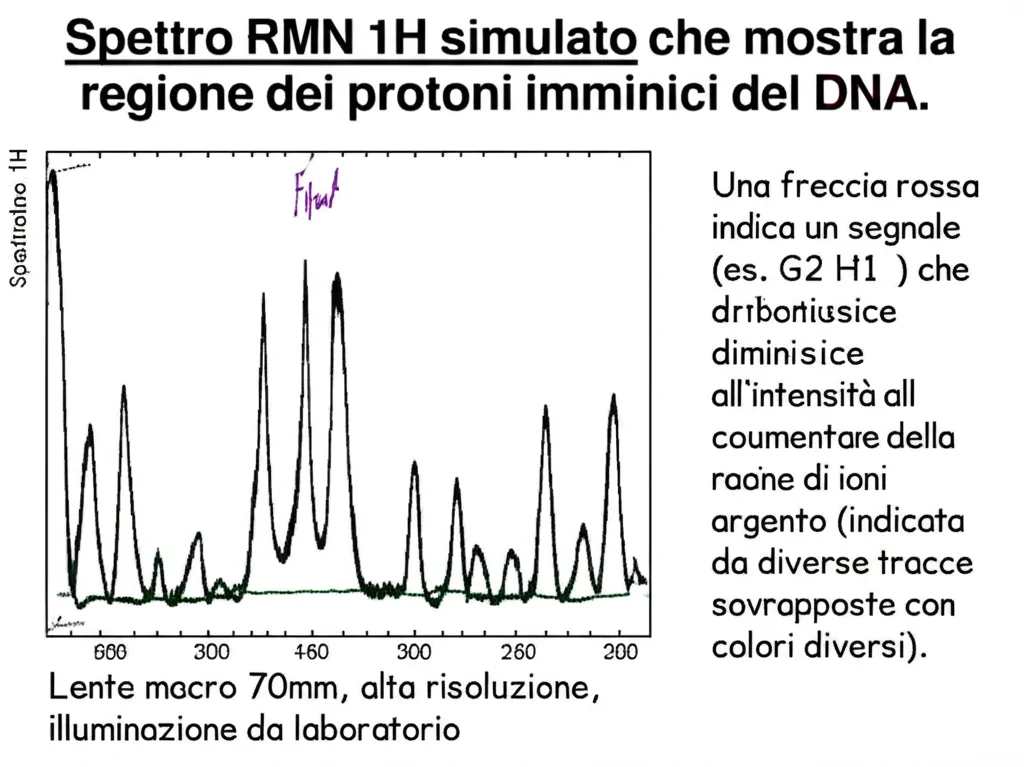
Poi abbiamo analizzato gli spettri RMN del protone (1H), concentrandoci sui segnali delle basi azotate. Se l’argento si fosse legato all’atomo N7 delle purine (accessibile dalla scanalatura maggiore), ci saremmo aspettati che i segnali dei protoni H8 di tutte le adenine e guanine fossero influenzati in modo simile. Invece, questi segnali rimanevano relativamente stabili con l’aggiunta di 3 ioni argento per duplex. Al contrario, i segnali più perturbati erano quelli dei protoni H5 e H6 delle citosine e, soprattutto, quelli dei protoni imminici (H1 delle guanine, H3 delle timine) e amminici (H41/H42 delle citosine) coinvolti nei legami idrogeno che tengono uniti i due filamenti!
4. L’Indiziato Principale: Le Coppie di Basi Interne (via Watson-Crick):
I cambiamenti più eclatanti riguardavano i protoni imminici delle guanine (G H1) e i protoni amminici delle citosine (C H41/H42), specialmente quelli delle coppie G:C. In particolare, il segnale del protone G2 H1 (la guanina nella seconda posizione) diminuiva drasticamente fino a scomparire con 3 ioni argento per duplex. Contemporaneamente, i segnali dei protoni amminici della sua citosina complementare (C11) indicavano la rottura del legame idrogeno. Questo è un forte indizio! La scomparsa del segnale G H1 suggerisce che l’argento potrebbe sostituire proprio quel protone, formando una coppia di basi modificata G–Ag+–C attraverso il margine di Watson-Crick (quello usato nei normali appaiamenti). Poiché gli spettri CD non mostravano grandi cambiamenti a queste basse concentrazioni, abbiamo escluso un legame significativo tramite il margine di Hoogsteen, che richiederebbe una riorganizzazione strutturale più importante.
5. L’Ingresso dalle Estremità:
Un altro dettaglio cruciale: i segnali delle coppie G:C più vicine alle estremità dell’elica (come G2:C11) erano molto più influenzati rispetto a quelli delle coppie G:C più interne (come G4:C9). Questo suggerisce fortemente che gli ioni argento non entrino a caso nella doppia elica, ma preferiscano “infiltrarsi” dalle estremità, che sono note per essere più flessibili e accessibili (“fraying”).
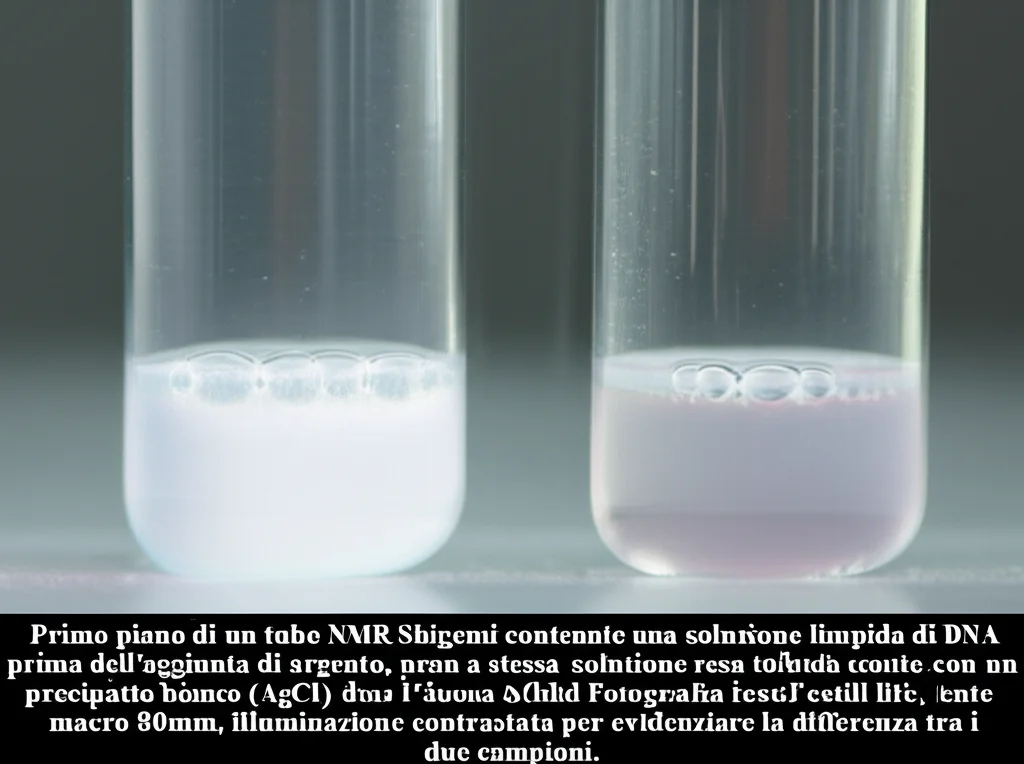
6. Un Legame Reversibile:
Infine, abbiamo fatto un esperimento interessante: abbiamo aggiunto ioni cloruro (Cl-) alla soluzione contenente DNA e argento. Immediatamente si è formato un precipitato bianco di cloruro d’argento (AgCl), e gli spettri RMN del DNA sono tornati quasi identici a quelli originali! Questo dimostra che il legame tra l’argento e il DNA non modificato è relativamente labile e può essere facilmente rotto in presenza di un controione che forma un sale insolubile con l’argento.
Conclusioni: Un Primo Contatto Intimo
Mettendo insieme tutti i pezzi del puzzle, il nostro “spionaggio” molecolare con la RMN ci ha permesso di trarre alcune conclusioni importanti sui primi passi dell’interazione Ag+-DNA:
- Gli ioni argento inizialmente preferiscono legarsi *all’interno* della doppia elica B-DNA, interagendo direttamente con le basi azotate.
- Il legame non avviene primariamente né con lo scheletro fosfato né con l’atomo N7 delle purine nella scanalatura maggiore.
- Il processo dominante sembra essere la formazione di coppie di basi modificate dall’argento, probabilmente G–Ag+–C, attraverso la sostituzione di un protone nel legame idrogeno di Watson-Crick.
- Gli ioni argento sembrano entrare nell’elica a partire dalle estremità più flessibili, influenzando maggiormente le coppie di basi terminali (specialmente G:C).
- Questo legame iniziale è relativamente debole e reversibile.
- Solo a concentrazioni più elevate di argento (oltre 3-4 ioni per duplex) iniziano significative riorganizzazioni strutturali, che portano alla formazione di aggregati con probabili coppie mediate da argento non-canoniche.
Questi risultati aggiornano e forniscono dettagli molecolari a osservazioni fatte decenni fa con altre tecniche. Capire questi siti di legame iniziali è cruciale per progettare in modo più razionale sistemi basati su DNA e metalli, ad esempio per costruire nanostrutture o sensori specifici.
Naturalmente, la storia non finisce qui. Ci sono ancora molti dettagli da chiarire, magari usando isotopi specifici o sequenze di DNA diverse. Ma per ora, abbiamo gettato un po’ più di luce su questa affascinante danza molecolare tra un metallo nobile e la molecola della vita. È incredibile pensare a come queste interazioni, invisibili ai nostri occhi, governino processi così fondamentali!
Fonte: Springer