Antidepressivi SSRI: Un Rischio Nascosto per il Cuore del Bebè?
Amici della scienza, ben ritrovati! Oggi voglio parlarvi di un argomento che tocca corde molto sensibili: la salute dei nostri cuori e, in particolare, quella dei più piccoli, ancora prima che vengano al mondo. Parliamo di farmaci comunissimi, gli inibitori selettivi della ricaptazione della serotonina, meglio noti come SSRI. Molti di noi li conoscono, magari li usano o conoscono qualcuno che li usa per trattare la depressione. Sono un aiuto prezioso, non c’è dubbio. Ma, come spesso accade nella scienza, c’è sempre un “ma”, un lato della medaglia che merita di essere esplorato a fondo.
Recentemente, la comunità scientifica ha iniziato a puntare i riflettori su un potenziale legame tra l’assunzione di SSRI durante la gravidanza e un aumento del rischio di difetti cardiaci congeniti nei neonati. Una notizia che, lo capisco bene, può generare ansia. Ma è proprio per questo che la ricerca non si ferma: per capire, per prevenire, per proteggere. E oggi voglio raccontarvi di uno studio affascinante che ha cercato di andare a fondo di questa questione, svelando i meccanismi con cui questi farmaci potrebbero, e sottolineo potrebbero, influenzare lo sviluppo cardiaco.
Gli SSRI: Un Breve Ripasso e i Primi Sospetti
Prima di addentrarci nello studio, facciamo un piccolo passo indietro. Gli SSRI, come la fluoxetina, la paroxetina e la sertralina, agiscono aumentando i livelli di serotonina nel cervello, un neurotrasmettitore che gioca un ruolo chiave nel regolare l’umore. Sono tra i farmaci più prescritti per la depressione, e il loro uso in gravidanza è aumentato significativamente negli ultimi anni. Si stima che a livello internazionale circa il 3% delle donne incinte li assuma, con picchi del 6% negli Stati Uniti.
Ora, se da un lato aiutano la mamma, dall’altro è emerso che gli SSRI possono attraversare la barriera placentare, raggiungendo il feto. E qui nascono le preoccupazioni. Studi precedenti avevano già segnalato effetti avversi negli adulti, come aritmie o fibrillazione atriale, e nei neonati esposti in utero, una condizione nota come “sindrome da adattamento neonatale”, con sintomi come irritabilità, tremori e difficoltà respiratorie. Ma il campanello d’allarme più serio riguarda proprio l’aumento del rischio di malformazioni cardiache congenite, specialmente se l’esposizione avviene nel primo trimestre.
La Scienza in Laboratorio: Cuori in Provetta per Capire Meglio
Ed eccoci al cuore (è il caso di dirlo!) della ricerca che vi sto presentando. Per investigare gli effetti tossici degli SSRI sul sistema cardiaco, gli scienziati hanno utilizzato un approccio super innovativo: hanno preso delle cellule staminali pluripotenti umane (hPSC) e le hanno trasformate! Sì, avete capito bene. Le hanno differenziate in cardiomiociti, cioè le cellule muscolari del cuore, creando modelli sia bidimensionali (un singolo strato di cellule, tipo un tappeto) sia tridimensionali, dei veri e propri organoidi cardiaci. Pensate a dei mini-cuori che battono in laboratorio! Questi modelli sono fantastici perché evitano le differenze tra specie che si avrebbero usando animali e permettono di studiare lo sviluppo cardiaco umano in modo molto più diretto.
I ricercatori hanno quindi esposto questi cardiomiociti e organoidi a tre SSRI comuni: fluoxetina, paroxetina e sertralina, a concentrazioni simili a quelle riscontrate nel sangue dei pazienti. E cosa hanno osservato? Preparatevi, perché i risultati sono piuttosto eloquenti.
I Risultati: Quando le Centrali Energetiche Vanno in Tilt
Partiamo dai cardiomiociti in 2D. L’esposizione agli SSRI ha portato a una serie di problemi a catena. Innanzitutto, hanno notato una riduzione della produzione di ATP. L’ATP, per chi non lo sapesse, è la molecola energetica fondamentale per le nostre cellule; senza ATP, le cellule non possono funzionare correttamente. Immaginate le centrali elettriche di una città che iniziano a produrre meno energia: un bel guaio, vero?
Ma perché questa carenza di energia? Gli scienziati hanno scoperto che gli SSRI interferivano con la respirazione mitocondriale. I mitocondri sono proprio le nostre centrali energetiche cellulari. L’esposizione prolungata (cinque giorni) a concentrazioni cliniche di SSRI diminuiva la respirazione basale e massimale dei mitocondri. Non solo: aumentavano anche i livelli di specie reattive dell’ossigeno (ROS), molecole che, in eccesso, causano stress ossidativo e danneggiano le cellule.
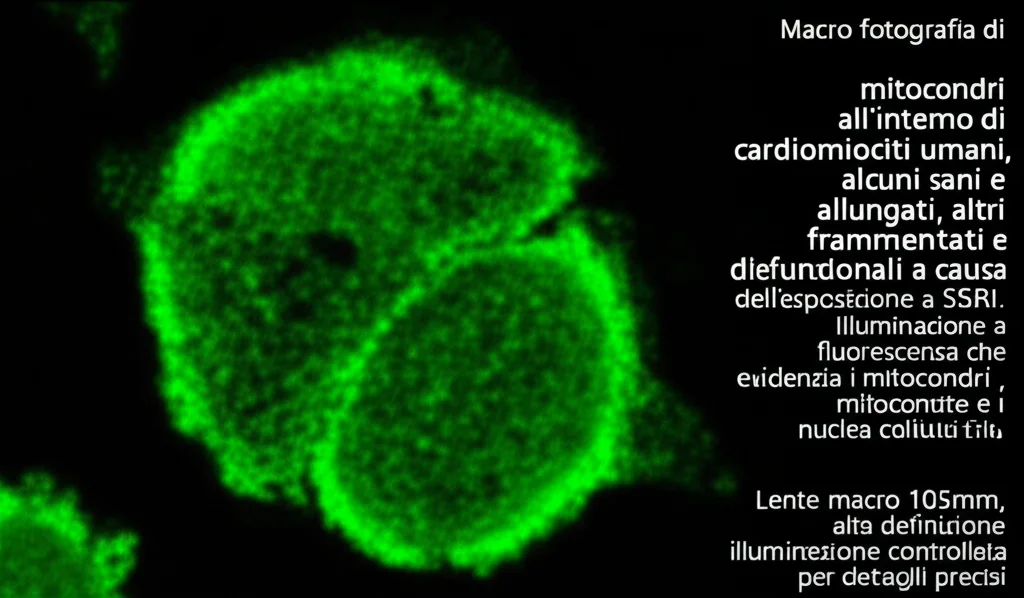
Quando poi hanno simulato un’esposizione durante lo sviluppo dei cardiomiociti (usando concentrazioni definite NOAEL, cioè il livello al quale non si osservano effetti avversi apparenti come l’arresto del battito), i problemi si sono confermati: ridotta produzione di ATP, potenziale di membrana mitocondriale alterato e respirazione mitocondriale compromessa. Ma non è finita qui. L’esposizione a lungo termine agli SSRI durante la differenziazione ha anche portato a un’alterazione della struttura dei mitocondri (più piccoli e meno ramificati) e, cosa importantissima per il cuore, a una disorganizzazione dei sarcomeri.
I sarcomeri sono le unità contrattili fondamentali del muscolo cardiaco. Se i sarcomeri sono disorganizzati, il cuore non può contrarsi in modo efficiente. Pensate a una squadra di canottaggio dove tutti remano fuori tempo: la barca non va dritta! In particolare, la lunghezza dei sarcomeri diminuiva con la paroxetina, e l’organizzazione generale era ridotta con tutti e tre gli SSRI testati.
L’Analisi Genetica: Indizi nel DNA
Per capire ancora più a fondo, i ricercatori hanno analizzato l’espressione genica (RNA-seq). Hanno scoperto che gli SSRI alteravano l’attività di numerosi geni. Tra questi, uno particolarmente interessante è MYH7, un gene cruciale per l’organizzazione dei sarcomeri. La sua espressione diminuiva significativamente con tutti e tre gli SSRI, il che si collega perfettamente alla disorganizzazione sarcomamerica osservata. Un altro gene, PGAM5, legato alla salute mitocondriale (fissione, biogenesi, mitofagia), risultava aumentato con la paroxetina, suggerendo un tentativo della cellula di rispondere al danno mitocondriale, ma che potrebbe portare a un’eccessiva frammentazione dei mitocondri se lo stress è severo.
Passaggio al 3D: Gli Organoidi Confermano e Aggiungono Dettagli
E gli organoidi cardiaci 3D? Questi modelli, ancora più complessi, hanno sostanzialmente confermato i risultati ottenuti con le cellule 2D per quanto riguarda la disfunzione mitocondriale (ridotta respirazione e produzione di ATP) dopo esposizione a paroxetina. Ma hanno anche rivelato dettagli aggiuntivi. L’analisi istologica e immunoistochimica ha mostrato che la paroxetina poteva influenzare lo sviluppo cardiaco e l’angiogenesi (la formazione di nuovi vasi sanguigni).
In particolare, hanno osservato un aumento del marcatore CD31, che indica un incremento delle cellule endoteliali (quelle che formano i vasi), e una diminuzione di WT1, un gene essenziale per molti aspetti dello sviluppo cardiaco, inclusa la formazione delle valvole e la maturazione del miocardio. Anche negli organoidi, l’espressione del gene MYH7 era ridotta, confermando il problema ai sarcomeri. Inoltre, l’analisi genica negli organoidi ha evidenziato alterazioni in geni legati all’emostasi (il processo di coagulazione del sangue), come FGB e VTN, il che potrebbe correlarsi a segnalazioni cliniche di disturbi emorragici associati agli SSRI.

Altri geni importanti per la struttura e la funzione del sarcomero, come ANKRD1, MYL2, e un gruppo di altri 9 geni correlati all’organizzazione sarcomamerica, risultavano down-regolati, fornendo ulteriori prove molecolari della disorganizzazione strutturale osservata.
Cosa Ci Dice Tutto Questo? Implicazioni e Prospettive Future
Mettendo insieme tutti i pezzi, questo studio ci offre un quadro piuttosto dettagliato di come gli SSRI potrebbero esercitare effetti cardiotossici, specialmente durante lo sviluppo fetale. Il meccanismo principale sembra coinvolgere una disfunzione dei mitocondri (meno energia, più stress ossidativo, alterazioni strutturali) e una disorganizzazione dei sarcomeri, le fondamenta della contrazione cardiaca. Geni chiave come MYH7 e PGAM5 sembrano giocare un ruolo centrale in questi processi.
È fondamentale sottolineare che questi sono studi in vitro, su modelli cellulari, seppur molto avanzati. Non significano automaticamente che ogni donna che assume SSRI in gravidanza avrà un bambino con problemi cardiaci. La depressione in gravidanza è una condizione seria che richiede un trattamento adeguato, e i benefici degli SSRI possono superare i potenziali rischi in molti casi. Tuttavia, questi risultati rafforzano la necessità di un’attenta valutazione del rapporto rischio-beneficio e di un monitoraggio accurato quando si prescrivono questi farmaci a donne incinte o che pianificano una gravidanza.
La bellezza della scienza è che ogni scoperta apre la porta a nuove domande e nuove possibilità. Questi risultati potrebbero spingere verso lo sviluppo di terapie antidepressive più sicure per l’uso in gravidanza o strategie per mitigare i potenziali effetti cardiotossici. Per ora, quello che possiamo fare è essere informati, discutere apertamente con i nostri medici e supportare la ricerca che continua a lavorare per la nostra salute e quella delle future generazioni.
Insomma, un campo di ricerca in continua evoluzione, che ci ricorda quanto sia complesso e meraviglioso il corpo umano, e quanto sia importante continuare a studiarlo per proteggerlo al meglio. Alla prossima, amici della scienza!
Fonte: Springer