Anticorpi Super Lunghi: Il Segreto della Loro Stabilità è (Quasi) Universale!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi affascina da matti nel mondo della biologia: gli anticorpi. Avete presente quelle fantastiche molecole a forma di Y che il nostro sistema immunitario (e quello di altri animali) usa per acchiappare virus e batteri? Ecco, proprio loro. La loro magia sta in delle piccole regioni, chiamate regioni ipervariabili o CDR (Complementarity-Determining Regions), che sono come delle “mani” super specifiche capaci di afferrare un nemico ben preciso, l’antigene.
Normalmente, queste “mani” (soprattutto una chiamata CDR-H3) non sono lunghissime. Nell’uomo, parliamo di 6-20 amminoacidi, i mattoncini delle proteine. Ma qui arriva il bello: alcune mucche, sì, proprio le mucche, producono anticorpi decisamente fuori dal comune. Hanno dei CDR-H3 lunghissimi, che chiamiamo ulCDR (ultra-long CDR), composti anche da 70 amminoacidi! Immaginateveli come un lungo braccio (lo “stalk” o gambo) con una specie di “pomo” o “nodo” all’estremità (il “knob”). È proprio questo knob super variabile che fa il lavoro sporco, legandosi all’antigene.
La domanda che mi ronzava in testa
Ma come fanno questi anticorpi così strani a mantenersi stabili e funzionanti? Come fa la struttura a reggere con questi “bracci” così lunghi e diversi tra loro? Questa è la domanda che mi (e ci) ha spinto a indagare. In particolare, ci siamo chiesti: cosa succede se prendiamo diversi di questi ulCDR naturali, con sequenze e forme diverse, e li “montiamo” sulla stessa impalcatura di base di un anticorpo? Cambierà tutto? Crollerà la struttura? Smetteranno di funzionare?
L’esperimento: un “taglia e cuci” molecolare
Per rispondere, abbiamo fatto proprio questo: abbiamo preso l’impalcatura di un frammento di anticorpo bovino modello (chiamato Fab NC-Cow1) e abbiamo sostituito il suo ulCDR originale con altri sei ulCDR naturali diversi, presi da altri anticorpi bovini. Questi ulCDR erano belli diversi tra loro, con poca somiglianza nella sequenza di amminoacidi. In pratica, abbiamo creato delle varianti “Frankenstein” dove circa il 10% della proteina era diverso in ogni versione. Abbiamo anche creato una versione “senza pomo” (Δknob), togliendo il knob e lasciando solo il gambo (sostituito da glicine, amminoacidi semplici).
La prima buona notizia: tutte le nostre varianti modificate sono state prodotte senza problemi dalle cellule in laboratorio. Questo già ci diceva qualcosa sulla loro “robustezza”. Poi le abbiamo purificate per studiarle meglio.
La scoperta che ci ha lasciati a bocca aperta: stabilità quasi identica!
E qui arriva la sorpresa più grande. Quando siamo andati a misurare la stabilità termica, cioè quanto calore serve per farle “disfare” (denaturare), abbiamo scoperto che tutte le varianti con gli ulCDR scambiati erano straordinariamente simili! I loro punti di fusione (Tm, la temperatura a cui metà delle proteine si sono denaturate) erano tutti raccolti in un intervallo strettissimo, tra 66 e 70 °C. Accidenti! Cambiare un pezzo così lungo e variabile sembrava avere un impatto minimo sulla stabilità generale dell’impalcatura.
Abbiamo usato diverse tecniche per confermarlo:
- DSF (Differential Scanning Fluorimetry): Misura come cambia la fluorescenza della proteina mentre la si scalda. Tutte le curve di “fusione” erano molto simili e ripide, indicando una denaturazione cooperativa (tutta la proteina cede più o meno insieme). Solo una variante (var4) sembrava un po’ meno “decisa” nel disfarsi.
- DLS (Dynamic Light Scattering): Misura le dimensioni delle proteine in soluzione e come tendono ad aggregarsi col calore. Anche qui, tutte le varianti avevano dimensioni simili (vicine al valore teorico) e iniziavano ad aggregarsi a temperature molto vicine tra loro (tra 57 e 63 °C). La variante senza knob era leggermente più piccola e un po’ più resistente all’aggregazione.
Questo risultato è pazzesco se pensate che negli anticorpi “normali” c’è molta più variabilità nelle temperature di fusione. Qui, sembra che la natura abbia trovato un modo per rendere questi ulCDR diversi compatibili con una stessa base strutturale, mantenendo una stabilità quasi costante. È come se l’impalcatura fosse progettata per “accettare” diversi tipi di bracci lunghi senza scomporsi troppo.
Curiosamente, quando abbiamo confrontato le nostre varianti “swap” con gli anticorpi originali da cui avevamo preso gli ulCDR (i “parent Fabs”), abbiamo visto che questi ultimi erano ancora più stabili (Tm più alte di 4-8 °C). Questo ci dice che, sì, l’impalcatura specifica dell’anticorpo originale conta per la stabilità assoluta, ma il punto chiave è che scambiare diversi ulCDR naturali su una stessa impalcatura comune ha un effetto sorprendentemente piccolo sulla stabilità relativa.
E il legame all’antigene? Funziona ancora!
Ok, la stabilità è simile, ma questi anticorpi modificati fanno ancora il loro lavoro? Riescono ancora a legare i loro bersagli specifici? Per scoprirlo, abbiamo usato una tecnica chiamata BLI (Biolayer Interferometry), che misura in tempo reale come le molecole si legano tra loro.
I bersagli (antigeni) erano diversi per i vari ulCDR che avevamo usato:
- Un pezzo del virus HIV (Env trimer) per l’anticorpo originale (wt) e la variante 1 (var1).
- Una proteina umana chiamata EGFR (recettore del fattore di crescita epidermico) per le varianti 2, 3 e 4.
- Un’altra proteina umana, Nkp30, per le varianti 5 e 6.
Ebbene sì! Tutte e sei le varianti con gli ulCDR scambiati mantenevano la capacità di legarsi al loro antigene specifico, e lo facevano con alta affinità (nell’ordine dei nanomolari, che è un legame bello forte). L’affinità era solo leggermente più bassa per var1 rispetto al suo “genitore”, ma praticamente identica per var3 e var4. Ovviamente, la variante senza knob (Δknob) non legava più nulla, confermando che è proprio il knob la parte che afferra l’antigene.
Abbiamo anche verificato con un’altra tecnica (SEC-MALS) che gli anticorpi formassero complessi con i loro antigeni nelle giuste proporzioni (stechiometrie). Qui abbiamo notato una cosa interessante per la variante 3 (e anche per il suo genitore): una parte significativa di queste molecole non riusciva a legare l’antigene EGFR, pur essendo apparentemente “sana” e stabile. L’ipotesi è che forse, in queste molecole, i ponti disolfuro (legami chimici importanti per la forma) all’interno del knob non si formino sempre nel modo giusto, creando isomeri diversi di cui solo uno è funzionale per il legame. Un dettaglio intrigante da approfondire!
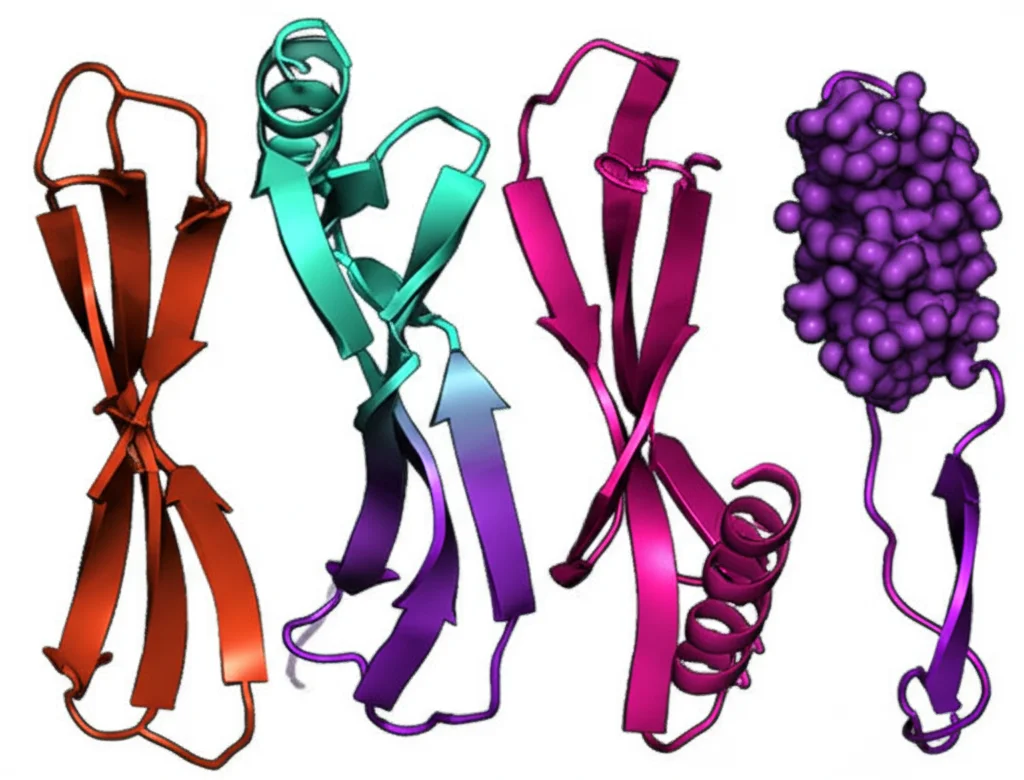
Uno sguardo alla struttura: simili ma non identiche
Visti i risultati su stabilità e legame, volevamo capire se ci fossero differenze strutturali tra le varianti. Abbiamo usato diverse tecniche spettroscopiche:
- Dicroismo Circolare (CD) nel lontano UV: Analizza la struttura secondaria (come si organizzano le catene proteiche, ad esempio in foglietti beta o eliche alfa). Risultato: spettri quasi identici per tutte le varianti! Tutte mostravano la tipica firma delle proteine ricche di foglietti beta, come ci si aspetta per gli anticorpi. Lo scambio di ulCDR non alterava l’organizzazione generale dell’impalcatura.
- Spettroscopia a Modulazione Microfluidica (MMS): Un’altra tecnica per guardare la struttura secondaria usando la luce infrarossa. Anche qui, grandissima somiglianza tra tutte le varianti.
- Dicroismo Circolare (CD) nel vicino UV e NMR (Risonanza Magnetica Nucleare): Queste tecniche sono più sensibili alla struttura terziaria (la forma 3D complessiva) e all’ambiente locale di certi amminoacidi. Qui abbiamo notato piccole differenze, probabilmente dovute proprio ai diversi amminoacidi e ponti disolfuro presenti nei vari ulCDR. Le differenze maggiori si vedevano per var1 e la variante senza knob.
Insomma, a livello generale la struttura dell’impalcatura rimaneva solidissima e molto simile in tutte le varianti, nonostante le differenze nei lunghi “bracci” ulCDR.
Scavando più a fondo: HDX-MS e Simulazioni Molecolari
Ma allora, da dove venivano quelle piccole differenze di stabilità che avevamo comunque notato (ad esempio, la denaturazione meno “cooperativa” di var4)? Per capirlo, siamo passati a tecniche ancora più sofisticate che ci permettono di vedere come “respira” e si muove la proteina a livello di singole regioni.
Abbiamo usato l’HDX-MS (Hydrogen-Deuterium Exchange Mass Spectrometry). In pratica, mettiamo la proteina in acqua “pesante” (con deuterio invece di idrogeno) e vediamo quali parti della proteina scambiano più velocemente i loro idrogeni con il deuterio. Le parti più esposte o flessibili lo fanno prima. Confrontando la variante senza knob (la più stabile) con le altre (wt, var4, var5), abbiamo visto che:
- Tra Δknob, wt e var5 c’erano pochissime differenze.
- La variante var4, invece, mostrava diverse regioni che scambiavano idrogeni più velocemente (erano più “deprotette”), sia nella catena pesante (Fd) che nella catena leggera (LC). Molte di queste regioni erano vicine alla base del gambo (stalk). In particolare, una regione della catena leggera (residui 88-107), che sappiamo interagire con il gambo, era significativamente più esposta in var4.
Questo suggerisce che le piccole differenze nel gambo di var4 causano interazioni leggermente meno “strette” con l’impalcatura sottostante, in particolare con la catena leggera.
Per confermare, abbiamo fatto anche delle simulazioni di dinamica molecolare (MD) al computer. Abbiamo simulato il comportamento delle parti variabili (VH e VL) di wt, Δknob, var4 e var5. Le simulazioni hanno mostrato che proprio in var4 e var5, la regione del gambo e quella specifica della catena leggera (LC 88-107) erano più flessibili rispetto a wt e Δknob. Bingo! Le simulazioni confermavano le osservazioni sperimentali dell’HDX-MS.
Cosa ci portiamo a casa? Implicazioni per il futuro
Questa ricerca ci ha rivelato un principio fondamentale piuttosto sorprendente: negli anticorpi bovini con ulCDR, diversi “bracci” naturali (ulCDR) possono essere innestati sulla stessa impalcatura di base (Fab scaffold) con un impatto minimo sulla stabilità termica e sulla struttura secondaria generale. Inoltre, la capacità di legare l’antigene con alta affinità viene mantenuta. È come se ci fosse una sorta di “convergenza di stabilità”: la natura ha selezionato ulCDR che, pur essendo diversi per legare antigeni differenti, sono strutturalmente compatibili con un’impalcatura comune e conservata, specialmente grazie al contributo stabilizzante della catena leggera (LC), che in questi anticorpi è molto conservata.
Questa scoperta è eccitante perché apre nuove strade per l’ingegneria degli anticorpi. Sapere che possiamo scambiare questi lunghi domini funzionali (i knob, responsabili del legame) mantenendo una struttura stabile potrebbe semplificare la progettazione di nuovi anticorpi terapeutici o diagnostici. Si potrebbe pensare di:
- Prendere un’impalcatura bovina stabile e innestarci sopra knob diversi con le specificità desiderate.
- Provare a “umanizzare” questi sistemi, magari trovando un’impalcatura umana sufficientemente stabile che possa ospitare un “gambo” artificiale e poi diversi knob.
Il fatto che i knob siano così diversi e funzionali, ma non destabilizzino l’anticorpo, supporta l’idea di usarli come “mini-anticorpi” o moduli funzionali da attaccare ad altre molecole.
Insomma, le mucche con i loro anticorpi “extra-large” ci hanno insegnato ancora una volta quanto possa essere creativa e robusta l’evoluzione, e ci hanno dato nuovi spunti per creare strumenti potenti per la biomedicina. La ricerca continua!
Fonte: Springer