Anlotinib: Una Nuova Speranza Contro il Cancro della Lingua? Come “Sveglia” il Sistema Immunitario
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della lotta contro i tumori, in particolare contro una forma piuttosto aggressiva: il carcinoma squamocellulare della lingua (TSCC), più comunemente noto come cancro della lingua. Sapete, questo tipo di cancro è tra i più comuni del cavo orale, molto maligno e con una brutta tendenza a dare metastasi precoci ai linfonodi del collo. Un bel problema, insomma.
Le Terapie Attuali e i Loro Limiti
Normalmente, la prima linea d’attacco è la chirurgia, spesso seguita da radioterapia e chemioterapia. Il farmaco standard per la chemio è il cisplatino. Tuttavia, come spesso accade in oncologia, le cellule tumorali possono diventare resistenti ai farmaci, e si pensa che questo sia legato a una sorta di “soppressione” del nostro sistema immunitario all’interno del tumore. È come se il cancro dicesse al nostro corpo: “Ehi, tu stai buono lì, non disturbarmi mentre cresco!”.
L’Idea Rivoluzionaria: La Morte Cellulare Immunogenica (ICD)
Qui entra in gioco un concetto super interessante: la Morte Cellulare Immunogenica (ICD). Per anni si è pensato che la morte delle cellule tumorali indotta da chemio e radio fosse “silenziosa”, cioè non stimolasse il sistema immunitario. Invece, studi recenti hanno mostrato che, in certe condizioni, quando le cellule tumorali muoiono, possono rilasciare delle molecole speciali che funzionano come un campanello d’allarme per le nostre difese. Queste molecole, chiamate Pattern Molecolari Associati al Danno (DAMPs), rendono le cellule tumorali “visibili” e “riconoscibili” dal sistema immunitario, scatenando una risposta antitumorale più forte. È come se la cellula tumorale morente urlasse: “Aiuto! Sono qui! Venite a prendermi (e anche le mie sorelle)!”.
I DAMPs chiave in questo processo sono:
- Calreticulina (CRT): Esposta sulla superficie cellulare, agisce come un segnale “mangiami” per le cellule immunitarie.
- Proteina da shock termico 70 (HSP70): Anch’essa esposta in superficie, aiuta a presentare pezzi del tumore (antigeni) al sistema immunitario.
- High Mobility Group Box 1 (HMGB1): Rilasciata all’esterno, stimola la maturazione delle cellule presentanti l’antigene (come le cellule dendritiche).
- Adenosina Trifosfato (ATP): Rilasciata, attira le cellule immunitarie verso il tumore.
Il punto è che non tutti i farmaci chemioterapici sono capaci di innescare questo processo di ICD.
Anlotinib: Un Nuovo Protagonista?
Ed eccoci al cuore della questione. Ho voluto indagare su un farmaco relativamente nuovo, l’anlotinib cloridrato (AL3818). Questo farmaco è interessante perché ha una doppia azione: blocca la formazione di nuovi vasi sanguigni che nutrono il tumore (effetto anti-angiogenico) e inibisce direttamente la crescita tumorale agendo su diversi recettori chiave (VEGFR, PDGFR, FGFR, c-Kit). È già usato per altri tipi di cancro (polmone, esofago, colon-retto) e si sapeva che potesse indurre la morte cellulare (apoptosi) nel carcinoma squamocellulare orale. Mi sono chiesto: e se l’anlotinib fosse anche in grado di indurre la morte cellulare immunogenica nel cancro della lingua?

L’Esperimento: Anlotinib vs Paclitaxel (e Insieme!)
Per scoprirlo, ho preso una linea cellulare di cancro della lingua umano, chiamata Cal27, e l’ho messa alla prova in laboratorio. Ho confrontato l’effetto dell’anlotinib (AL3818) con quello del paclitaxel (PTX), un altro chemioterapico comune per questo tipo di tumore, che si sospettava potesse anch’esso indurre ICD. E, cosa ancora più intrigante, ho testato l’effetto della combinazione dei due farmaci (AL3818 + PTX).
Ecco cosa abbiamo fatto, in breve:
- Abbiamo determinato la concentrazione giusta dei farmaci per inibire la crescita delle cellule Cal27 (la cosiddetta IC50).
- Abbiamo misurato quanta apoptosi (morte cellulare programmata) inducevano i farmaci, da soli e in combinazione.
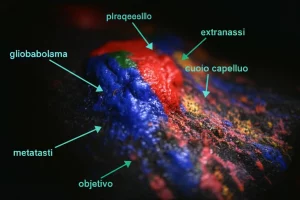
- Abbiamo cercato i segnali della ICD: abbiamo misurato i livelli di CRT e HSP70 sulla superficie delle cellule e nel loro interno (usando immunofluorescenza e citometria a flusso).
- Abbiamo misurato quanto HMGB1 veniva rilasciato dalle cellule nell’ambiente circostante (con un test ELISA).
- Abbiamo verificato i livelli di ATP rilasciato (con un test di luminescenza).
- Infine, ci siamo concentrati su come la CRT arriva sulla superficie cellulare, studiando una via di segnalazione specifica (PERK/eIF2a) con tecniche di Western Blot.
I Risultati: Cosa Abbiamo Scoperto?
I risultati sono stati davvero promettenti!
- Sia AL3818 che PTX hanno inibito la crescita delle cellule Cal27 e indotto apoptosi. La combinazione dei due è stata ancora più efficace nell’uccidere le cellule tumorali. Questo suggerisce un effetto sinergico!
- Entrambi i farmaci, e soprattutto la loro combinazione, hanno aumentato significativamente l’espressione dei marcatori di ICD: più CRT e HSP70 sulla superficie cellulare, e maggior rilascio di HMGB1 e ATP all’esterno. Ancora una volta, l’effetto combinato è stato il più potente.
- In particolare, l’anlotinib (AL3818) si è dimostrato molto efficace nell’indurre il rilascio di HMGB1, forse anche più del paclitaxel.
- Abbiamo visto che l’anlotinib induce l’esposizione precoce della CRT sulla membrana delle cellule Cal27.
- E non è tutto! Sembra che il meccanismo con cui l’anlotinib spinge la CRT verso la superficie cellulare sia legato all’attivazione (fosforilazione) della via di segnalazione PERK/eIF2a. Bloccando o attivando questa via, abbiamo visto cambiare l’esposizione della CRT sulla membrana, mentre la quantità totale di CRT dentro la cellula rimaneva più o meno la stessa. Questo è un dettaglio meccanicistico importante!

Cosa Significa Tutto Questo? Implicazioni Future
Questi risultati mi entusiasmano parecchio. Suggeriscono che l’anlotinib non solo combatte il cancro della lingua direttamente, ma potrebbe anche “addestrare” il sistema immunitario a riconoscere e attaccare il tumore, inducendo appunto la morte cellulare immunogenica. È come dare al nostro esercito interno le istruzioni giuste per trovare e colpire il nemico.
Il fatto che l’anlotinib, da solo o in combinazione con il paclitaxel, sia così efficace nell’aumentare i segnali DAMPs è fondamentale. Potrebbe significare che l’aggiunta di anlotinib ai regimi terapeutici attuali per il TSCC potrebbe:
- Migliorare l’efficacia della chemioterapia.
- Superare la resistenza ai farmaci, che spesso è legata all’immunosoppressione.
- Potenzialmente, rendere i tumori più sensibili all’immunoterapia, un’altra frontiera importantissima nella lotta contro il cancro.
L’anlotinib sembra essere almeno altrettanto bravo, se non superiore in certi aspetti (come l’induzione di HMGB1), del paclitaxel nell’attivare questa risposta immunitaria “nascosta”. Questo potrebbe essere particolarmente utile per quei pazienti che non rispondono bene al PTX.
Certo, siamo ancora a livello di studi su linee cellulari in laboratorio. Il prossimo passo sarà confermare questi risultati in modelli più complessi, magari co-colture con cellule immunitarie (come le cellule dendritiche) e poi in modelli animali (in vivo). Però, le basi teoriche che abbiamo gettato sono solide e aprono scenari terapeutici davvero interessanti.
In conclusione, l’anlotinib si profila come un candidato promettente non solo come farmaco mirato anti-tumorale e anti-angiogenico, ma anche come un potenziale induttore di morte cellulare immunogenica nel cancro della lingua. La sua capacità di “smascherare” il tumore di fronte al sistema immunitario, specialmente in combinazione con altri farmaci come il paclitaxel, potrebbe rappresentare un passo avanti significativo nel trattamento di questa difficile malattia. Continueremo a indagare!
Fonte: Springer