Alzheimer: Ho Scoperto Come un Gene ‘Buono’ Protegge il Cervello (C’entrano i Grassi!)
Ragazzi, parliamoci chiaro: l’Alzheimer è una brutta bestia, la forma più comune di demenza che mette a dura prova non solo chi ne soffre, ma anche famiglie e società intera. Per anni ci siamo concentrati su accumuli di proteine strane nel cervello, l’amiloide beta e la tau, ma diciamocelo, cure veramente efficaci ancora latitano.
Fortunatamente, la genetica ci sta dando una grossa mano. Grazie a studi enormi chiamati GWAS (Genome-wide association studies), abbiamo scovato più di 75 zone del nostro DNA legate al rischio di ammalarci di Alzheimer. È come avere una mappa del tesoro, ma senza sapere esattamente dove scavare o cosa cercare! Tra questi “punti caldi” genetici, uno dei più forti è vicino a un gene chiamato Clusterina (CLU).
Il Mistero della Clusterina e il suo Allele Protettivo
La Clusterina, un po’ come la sua “cugina” più famosa APOE (quella legata al rischio genetico più forte per l’Alzheimer), è un’apolipoproteina, cioè una proteina che trasporta grassi (lipidi) nel cervello. Finora, si pensava che CLU fosse coinvolta nella gestione dell’amiloide e della tau, un po’ come APOE. Ma c’è una differenza chiave: mentre APOE è prodotta principalmente dalle cellule di supporto del cervello (la glia, come astrociti e microglia), la CLU la troviamo sia nella glia che nei neuroni stessi. E il suo ruolo specifico nei neuroni, soprattutto riguardo ai lipidi, era un bel punto interrogativo.
Il problema con questi loci GWAS è che spesso contengono un sacco di varianti genetiche (SNP) tutte appiccicate insieme e tutte apparentemente legate alla malattia allo stesso modo. Capire quale sia la vera “colpevole” (o in questo caso, la “protettrice”) è un vero rompicapo. Nel caso di CLU, ci sono diversi SNP associati a un minor rischio di Alzheimer (un odds ratio di circa 0.9, significa che chi ha quella variante ha circa il 10% in meno di probabilità di ammalarsi). Ma quale di questi SNP fa davvero la differenza?
La Caccia al Tesoro nel DNA: Trovare lo SNP Funzionale
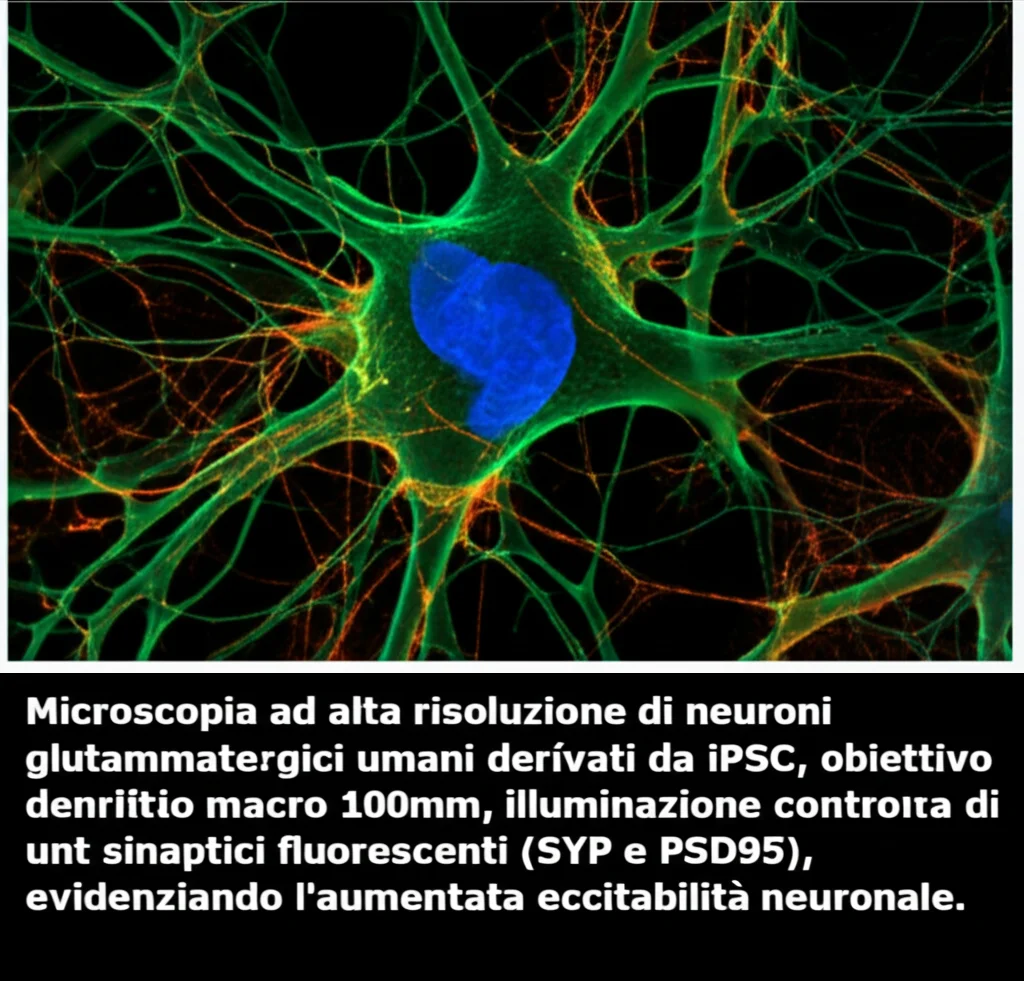
Qui entra in gioco la parte più “detective” del mio lavoro. Abbiamo usato una tecnica fichissima chiamata ASoC (Allele-Specific Open Chromatin) mapping. In pratica, siamo andati a vedere, in cellule cerebrali umane create in laboratorio da cellule staminali (iPSC), quali zone del DNA fossero “aperte” e accessibili, e se ci fossero differenze tra le due copie (alleli) di uno SNP che una persona eredita dai genitori. Se uno SNP si trova in una zona aperta e mostra questa differenza di accessibilità tra i due alleli, è molto probabile che sia lui quello “funzionale”, quello che cambia qualcosa a livello biologico.
Abbiamo analizzato neuroni di diverso tipo (glutammatergici, GABAergici, dopaminergici), astrociti e microglia derivati da iPSC. E indovinate un po’? Tra tutti gli SNP “sospetti” nel locus CLU, solo uno, chiamato rs1532278 (con le varianti T o C), si trovava in una regione di cromatina aperta e mostrava un ASoC significativo, soprattutto nei neuroni glutammatergici (iGlut) e dopaminergici. L’allele “T” di questo SNP è quello associato alla protezione dall’Alzheimer. Bingo! Avevamo il nostro candidato principale.
La Prova del Nove: CRISPR e l’Effetto sul Gene CLU
Ma un candidato non basta, servono prove concrete. Abbiamo usato la tecnologia CRISPR-Cas9, le famose “forbici genetiche”, per modificare cellule iPSC che avevano una copia T e una C (T/C) di rs1532278, creando linee cellulari “isogeniche”, cioè identiche tranne che per quel singolo SNP: alcune avevano solo la T (T/T, la versione protettiva) e altre solo la C (C/C, la versione più comune/a rischio relativo).
Poi abbiamo differenziato queste cellule in neuroni iGlut. Studiando queste cellule “gemelle diverse”, abbiamo scoperto un paio di cose fondamentali:
- L’allele protettivo T permette a un fattore di trascrizione chiamato ISL2 (una proteina che accende o spegne i geni) di legarsi meglio al DNA in quella regione.
- Questo legame più forte fa sì che i neuroni T/T producano circa il 40-50% in più di mRNA di CLU rispetto ai neuroni C/C.
- Di conseguenza, i neuroni T/T secernono anche più proteina CLU nell’ambiente circostante.
- Importante: questo effetto era specifico dei neuroni; negli astrociti creati dalle stesse cellule, non c’era differenza di espressione di CLU tra T/T e C/C.
Quindi, avevamo la prova: l’allele protettivo T di rs1532278 agisce nei neuroni aumentando la produzione di Clusterina.
Neuroni Più “Vivaci” Grazie all’Allele Protettivo
Ok, più CLU nei neuroni. E allora? Che effetto fa? Abbiamo messo questi neuroni T/T e C/C in coltura, a volte da soli, a volte insieme ad astrociti di topo (per poter distinguere la CLU umana da quella murina). I risultati sono stati sorprendenti:
- I neuroni T/T (con più CLU) avevano una morfologia più complessa, con più ramificazioni dendritiche.
- Mostravano una maggiore densità di sinapsi presinaptiche (marcatore SYP), suggerendo una migliore capacità di comunicare.
- Erano elettricamente più eccitabili: usando tecniche come il calcium imaging e le multi-electrode arrays (MEA), abbiamo visto che “sparavano” segnali elettrici più frequentemente e in modo più sincronizzato all’interno della rete neuronale.
Per essere sicuri che fosse proprio la CLU a fare questo, abbiamo fatto altri due esperimenti: abbiamo cancellato con CRISPR la regione di DNA (OCR) contenente lo SNP rs1532278, e questo ha ridotto sia la CLU che l’eccitabilità. Poi, abbiamo “restituito” la CLU a questi neuroni usando un virus modificato (AAV), e l’eccitabilità è tornata normale! Era la conferma: più CLU neuronale = neuroni più attivi e “in forma”.
Il Colpo di Scena: C’entrano i Grassi e la Comunicazione Neurone-Glia!
Qui le cose si sono fatte ancora più interessanti. Per capire come la CLU aumentasse l’eccitabilità, abbiamo analizzato l’espressione di tutti i geni (RNA-seq) nelle nostre co-colture di neuroni umani (T/T vs C/C) e astrociti di topo. Separando i dati umani da quelli murini, abbiamo visto cambiamenti enormi.
Nei neuroni T/T (più CLU), erano attivati geni legati alle sinapsi (confermando i dati precedenti), ma soprattutto… geni coinvolti nella sintesi di acidi grassi e colesterolo! Roba tipo HMGCR (l’enzima bersaglio delle statine) e SCD erano super attivi. Anche i percorsi del metabolismo energetico erano potenziati.
E negli astrociti che “convivevano” con i neuroni T/T? Anche lì, grandi cambiamenti, ma diversi: erano attivati geni legati alla β-ossidazione degli acidi grassi (il modo in cui le cellule bruciano i grassi per produrre energia), allo stress ossidativo (produzione di ROS, specie reattive dell’ossigeno) e al metabolismo energetico come la glicolisi.
Era chiaro: l’allele protettivo T di CLU non influenzava solo i neuroni, ma cambiava profondamente il dialogo metabolico tra neuroni e astrociti, soprattutto riguardo ai lipidi.

Lo “Scarico” dei Grassi: dai Neuroni agli Astrociti
Se i neuroni T/T producevano più grassi, ci si aspetterebbe di trovarne di più al loro interno, magari sotto forma di goccioline lipidiche (LDs), delle riserve di grasso cellulari. E invece… sorpresa! Abbiamo colorato le cellule per vedere le LDs e abbiamo scoperto che i neuroni T/T (e quelli in cui avevamo aumentato la CLU artificialmente) ne avevano meno dei neuroni C/C. Com’era possibile?
L’ipotesi: forse la CLU, essendo un trasportatore di lipidi, aiutava i neuroni a “scaricare” questi grassi in eccesso sugli astrociti vicini. Abbiamo testato questa idea con un esperimento di trasferimento lipidico: abbiamo “marcato” i grassi nei neuroni con una sonda fluorescente (Red C12) e poi li abbiamo messi in coltura vicino agli astrociti (senza contatto diretto). Risultato: gli astrociti che erano vicini ai neuroni T/T (più CLU) accumulavano molte più LDs fluorescenti rispetto a quelli vicini ai neuroni C/C! Abbiamo anche visto che la CLU prodotta dai neuroni (marcata con un tag “Flag”) finiva dentro gli astrociti e si trovava proprio insieme alle goccioline lipidiche.
Questo spiega il paradosso: i neuroni T/T producono più grassi ma se ne liberano più efficacemente grazie alla CLU, trasferendoli agli astrociti. Questo è probabilmente un bene, perché l’accumulo di LDs nei neuroni è spesso considerato dannoso.
Astrociti “Imballati” di Grassi: Conseguenze Inaspettate
Ok, quindi gli astrociti che interagiscono con i neuroni “protetti” (T/T) si riempiono di goccioline lipidiche. Che succede poi?
- Più Energia: Questi astrociti “carichi” producevano più corpi chetonici e lattato, due “carburanti” fondamentali che gli astrociti forniscono ai neuroni per sostenere la loro attività (soprattutto quella più intensa dei neuroni T/T).
- Più ROS: La β-ossidazione dei grassi produce anche ROS. E infatti, abbiamo misurato livelli più alti di ROS negli astrociti vicini ai neuroni T/T.
- Meno Assorbimento di Glutammato: Qui arriva il collegamento finale con l’eccitabilità neuronale. Gli astrociti hanno il compito fondamentale di “ripulire” lo spazio attorno alle sinapsi dal glutammato, il principale neurotrasmettitore eccitatorio. Troppo glutammato in giro può essere tossico o portare a iper-eccitabilità. Abbiamo scoperto che gli astrociti “carichi” di LDs e ROS assorbivano meno glutammato!
Abbiamo confermato che erano proprio i ROS a ridurre l’assorbimento di glutammato (usando un antiossidante, l’assorbimento tornava normale) e che era proprio la CLU secreta dai neuroni a mediare questo effetto (togliendo la CLU dal mezzo di coltura, l’effetto sull’assorbimento di glutammato spariva).

Il Quadro Completo: Un Nuovo Meccanismo di Protezione
Mettendo insieme tutti i pezzi, emerge un quadro affascinante:
- L’allele protettivo T dello SNP rs1532278 nel gene CLU aumenta l’espressione di CLU specificamente nei neuroni eccitatori.
- Questa maggiore CLU neuronale promuove l’eccitabilità dei neuroni stessi (più sinapsi, più attività).
- Contemporaneamente, facilita il trasferimento di lipidi dai neuroni agli astrociti vicini.
- Gli astrociti accumulano più goccioline lipidiche (LDs).
- Questo accumulo porta a una maggiore produzione di energia (chetoni, lattato) per i neuroni e a un aumento dei livelli di ROS negli astrociti.
- I ROS riducono la capacità degli astrociti di assorbire il glutammato dallo spazio sinaptico.
- Questa ridotta “pulizia” del glutammato contribuisce a mantenere o addirittura a promuovere l’aumentata eccitabilità dei neuroni T/T.
In pratica, l’allele protettivo di CLU non agisce solo sul neurone, ma orchestra una complessa comunicazione metabolica con gli astrociti, basata sui lipidi, che finisce per sostenere l’attività neuronale. Mantenere i neuroni attivi ed efficienti potrebbe essere una strategia chiave per resistere ai danni dell’Alzheimer, specialmente nelle fasi più avanzate dove spesso si osserva una riduzione dell’attività neuronale.
Certo, questo è un modello basato su cellule in laboratorio, e serviranno conferme in vivo. Ma questa scoperta apre strade completamente nuove per capire come fattori genetici, metabolismo lipidico e dialogo tra neuroni e glia si intreccino nella patologia dell’Alzheimer. E chissà, forse in futuro potremo sfruttare questi meccanismi per sviluppare nuove terapie mirate. La strada è ancora lunga, ma ogni pezzetto del puzzle che mettiamo a posto ci avvicina alla soluzione.
Fonte: Springer